Провигил: Лечење будности (потпуне информације о прописивању)
Робна марка: Провигил
Генеричко име: Модафинил
Садржај:
Опис
Фармакологија
Цлиницал Траилс
Индикације и употреба
Контраиндикације
Упозорења
Мере предострожности
Нежељене реакције
Злоупотреба и зависност од дрога
Предозирање
Дозирање и администрација
Како се испоручује
Информације о пацијенту Провигил (модафинил) (на обичном енглеском)
Опис
Провигил (модафинил) је средство које изазива будност за оралну примену. Модафинил је рацемско једињење. Хемијско име за модафинил је 2 - [(дифенилметил) сулфинил] ацетамид. Молекуларна формула је Ц15Х15НО2С, а молекулска тежина је 273,35.
Хемијска структура је:
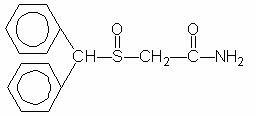
Модафинил је бели до готово бели кристални прах који је практично нерастворљив у води и циклохексану. Мало је растворљиво у метанолу и ацетону. Провигил таблете садрже 100 мг или 200 мг модафинила и следеће неактивне састојке: лактозу, микрокристална целулоза, прежелатинирани скроб, натријум кармелоза, повидон и магнезијум стеарат.
врх
Клиничка фармакологија
Механизам деловања и фармакологија
Није познат тачан механизам (механизме) кроз који модафинил потиче будност. Модафинил има промицање буђења сличне симпатомиметичким агенсима попут амфетамина и метилфенидата, мада фармаколошки профил није идентичан оном симпатомиметичких амина.
Модафинил има слабу до занемарљиве интеракције са рецепторима за норепинефрин, серотонин, допамин, ГАБА, аденозин, хистамин-3, мелатонин и бензодиазепине. Модафинил такође не инхибира активност МАО-Б или фосфодиестеразе ИИ-В.
Будност изазвана модафинилом може бити умањена од ± 1-адренергичког антагониста рецептора празосина; међутим, модафинил је неактиван у другим ин витро системима за које се зна да реагују на--адренергичке агонисте, као што је препарат за вас сере штакора.
Модафинил није агонист допаминских рецептора директно или индиректно. Међутим, ин витро, модафинил се везује за транспортер допамина и инхибира поновну употребу допамина. Ова активност је ин виво повезана са повећаним нивоом изванстаничне допамине у неким регионима мозга животиња. Код генетски инжењерских мишева којима је недостао допамински транспортер (ДАТ), модафинилу је недостајала активност која потиче буђење, што сугерише да та активност зависи од ДАТ-а. Међутим, ефекти модафинила који изазивају буђење, за разлику од амфетамина, нису активирали антагонист халоперидола рецептора допамина код пацова. Поред тога, алфа-метил-п-тирозин, инхибитор синтезе допамина, блокира деловање амфетамина, али не блокира локомоторну активност индуковану модафинилом.
У мачке, једнаке дозе метилфенидата и амфетамина које подстичу будност повећавале су активацију неурона у мозгу. Модафинил у еквивалентној дози која подстиче будност селективно и значајно повећава активацију неурона у дискретнијим регионима мозга. Веза овог налаза код мачака са ефектима модафинила на људе није позната.
Поред свог ефекта на буђење и способности повећања локомоторне активности код животиња, модафинил производи психоактивни и еуфорични ефекти, промјене у расположењу, перцепцији, размишљању и осјећајима типичним за друге стимулансе ЦНС-а код људи. Модафинил има ојачавајућа својства, о чему сведочи његова самостална примена код мајмуна који су претходно обучени за самосталну примену кокаина. Модафинил је такође делимично дискриминисан као подстицај стимуланса.
Оптички енантиомери модафинила имају слична фармаколошка дејства код животиња. Чини се да два главна метаболита модафинила, модафинилна киселина и модафинил сулфон не доприносе својствима модафинила који активирају ЦНС.
Фармакокинетика
Модафинил је рацемско једињење, чији енантиомери имају различиту фармакокинетику (нпр., Полуживот л-изомера је приближно три пута дужи од д-изомера у одраслих људи). Енантиомери се не претварају. У стабилном стању, укупна изложеност л-изомеру је приближно три пута већа од д-изомера. Најнижа концентрација (Ц)минсс) циркулирајући модафинил након дозирања једном дневно састоји се од 90% л-изомера и 10% д-изомера. Ефективни полуживот модафинила након вишеструких доза је око 15 сати. Енантиомери модафинила показују линеарну кинетику након вишеструког дозирања од 200-600 мг / дан једном дневно код здравих добровољаца. Очигледна устаљена стања укупног модафинила и л - (-) - модафинила достижу се након 2-4 дана дозирања.
Апсорпција
Апсорпција таблета Провигил је брза, а вршне концентрације у плазми појављују се за 2-4 сата. Биорасположивост Провигил таблета приближно је једнака воденој суспензији. Апсолутна орална биорасположивост није одређена због нерастворљивости воде (<1 мг / мЛ) модафинила, што је онемогућило интравенску примену. Храна нема утицаја на укупну биорасположивост Провигил-а; међутим, његова апсорпција (тмак) може се одложити за отприлике један сат ако се узима са храном.
Дистрибуција
Модафинил је добро распоређен у телесном ткиву са очигледном запреминском расподјелом (~ 0,9 Л / кг) већом од запремине укупне тјелесне воде (0,6 Л / кг). У људској плазми, ин витро, модафинил се умерено везује за протеин плазме (~ 60%, углавном за албумин). У серумским концентрацијама добијеним у стабилном стању после доза од 200 мг / дан, модафинил не показује померање протеина везивања варфарина, диазепама или пропранолола. Чак и у много већим концентрацијама (1000 уМ; > 25 пута више од Цмак од 40 уМ у стабилном стању од 400 мг / дан), модафинил нема утицаја на везивање варфарина. Модафинилна киселина у концентрацији> 500 уМ смањује опсег везивања варфарина, али ове концентрације су> 35 пута веће од терапеутских постигнутих.
Метаболизам и елиминација
Главни начин елиминације је метаболизам (~ 90%), пре свега од јетре, са накнадном бубрежном елиминацијом метаболита. Алкалинизација урина нема утицаја на елиминацију модафинила.
Метаболизам настаје хидролизном деамидацијом, С-оксидацијом, хидроксилацијом ароматског прстена и коњугацијом глукуронида. Мање од 10% администриране дозе излучује се као матично једињење. У клиничкој студији која је користила радиоактивно обележен модафинил, укупно 81% примењене радиоактивности је опорављено током 11 дана након дозе, претежно у урину (80% у односу на 1,0% у измету). Највећи део лека у урину била је модафинилна киселина, али најмање шест других метаболита било је присутно у нижим концентрацијама. Само два метаболита достижу уочљиве концентрације у плазми, тј. Модафинилну киселину и модафинил сулфон. У претклиничким моделима, модафинилна киселина, модафинил сулфон, 2 - [(дифенилметил) сулфонил] сирћетна киселина и 4-хидрокси модафинил нису били активни или није изгледало да посредују у ефектима буђења модафинила.
Код одраслих је понекад примећено смањење нивоа модафинила после више недеља дозирања, што сугерише аутоиндукција, али величина смањења и недоследност њихове појаве сугеришу њихов клинички значај је минималан. Примећено је значајно нагомилавање модафинил сулфона после вишеструких доза, због његовог дугог полувремена елиминације од 40 сати. Индукција метаболизујућих ензима, најважније цитокрома П-450 (ЦИП) 3А4, такође је примећена ин витро након инкубација примарних култура хуманих хепатоцита са модафинилом и ин виво након дуже примене модафинила на 400 мг / дан. (За даљу дискусију о ефектима модафинила на активности ензима ЦИП, види МЕРЕ ПРЕДОСТРОЖНОСТИ, Интеракције са лековима.)
Интеракције против дрога:
На основу података ин витро, модафинил се дијелом метаболизира помоћу 3А изоформе подфамије јетреног цитохрома П450 (ЦИП3А4). Поред тога, модафинил има потенцијал да инхибира ЦИП2Ц19, сузбија ЦИП2Ц9 и индукује ЦИП3А4, ЦИП2Б6 и ЦИП1А2. Будући да су модафинил и модафинил сулфон реверзибилни инхибитори ензима метаболизма лека ЦИП2Ц19, истодобна примена модафинила са лекови као што су диазепам, фенитоин и пропранолол, који се у великој мери елиминишу тим путем, могу повећати ниво циркулације тих једињења. Поред тога, код особа које имају недостатак ензима ЦИП2Д6 (тј. 7-10% популације Кавказа; сличне или ниже код других популација), нивоа супстрата ЦИП2Д6, попут трицикличких антидепресива и селективног серотонина инхибитори поновног преузимања, који имају помоћне путеве елиминације кроз ЦИП2Ц19, могу се повећати истодобном применом модафинил. Можда ће бити потребно прилагођавање дозе за пацијенте који се лече овим и сличним лековима (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Интеракције лијекова). Ин витро истраживање показало је да армодафинил (један од енантиомера модафинила) супстрат П-гликопротеина.
Истодобна примена модафинила са другим активним лековима ЦНС-а, попут метилфенидата и декстроамфетамина, није значајно изменила фармакокинетику било ког другог лека.
Откривено је да хронична примјена 400 мг модафинила смањује системску изложеност двама ЦИП3А4 супстрати, етинил естрадиол и триазолам, након оралне примене који сугеришу да је ЦИП3А4 био индуковано. Хронично давање модафинила може повећати елиминацију супстрата ЦИП3А4. Можда ће бити потребно прилагођавање дозе за пацијенте који се лече овим и сличним лековима (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Интеракције лијекова).
Запажено сузбијање активности ЦИП2Ц9 повезано са концентрацијом примећено је код хуманих хепатоцита након излагања модафинилу ин витро сугеришући да постоји потенцијал за метаболичку интеракцију између модафинила и супстрата овог ензима (нпр., С-варфарин, фенитоин). Међутим, у студији интеракције код здравих добровољаца, лечење хроничним модафинилом није показало значајан утицај на фармакокинетику варфарина у поређењу са плацебом. (Види МЕРЕ ПРЕДОСТРОЖНОСТИ, Интеракције лијекова, Остали лијекови, Варфарин).
Посебне популације
Родни ефекат:
Полна не утиче на фармакокинетику модафинила.
Аге Еффецт:
Запажено је незнатно смањење (~ 20%) оралног клиренса (ЦЛ / Ф) модафинила у студији са једном дозом од 200 мг у 12 испитаници са средњом старошћу од 63 године (распон 53 - 72 године), али сматра се да промена није клинички значајан. У студији са вишеструким дозама (300 мг / дан) код 12 пацијената са просечном старошћу од 82 године (распон 67 - 87 година), средња вредност нивои модафинила у плазми били су отприлике два пута виши од оних који су историјски добијени у млађих субјекти. Због потенцијалних ефеката вишеструких истодобних лекова са којима је учествовала већина пацијената лечене, очигледна разлика у фармакокинетикама модафинила не може се приписати само ефектима старење. Међутим, резултати сугерирају да се очишћење модафинила може смањити код старијих особа (види Дозирање и администрација).
Раце Еффецт:
Утицај расе на фармакокинетику модафинила није проучаван.
Оштећење бубрега:
У једном испитивању модафинила од једне дозе, тешки хронични затајење бубрега (клиренс креатинина 20 мл / мин) није значајно утичу на фармакокинетику модафинила, али повећана је изложеност модафинилној киселини (неактивном метаболиту) 9-пута (види МЕРЕ ПРЕДОСТРОЖНОСТИ).
Оштећење јетре:
Фармакокинетика и метаболизам су испитивани код пацијената са цирозом јетре (6 мушкараца и 3 жене). Три пацијента имала су цирозу Б или Б + (према критеријуму за дете), а 6 пацијената је имала стадију Ц или Ц + цирозу. Клинички 8 од 9 пацијената је било иктерично, а сви су имали асцитес. Код ових пацијената орални клиренс модафинила смањен је за око 60%, а концентрација устаљеног стања удвостручена је у поређењу с нормалним пацијентима. Дозу Провигила треба смањити код пацијената са тешким оштећењем јетре (види МЕРЕ ПРЕДОСТРОЖНОСТИ и Дозирање и администрација).
врх
Цлиницал Траилс
Ефикасност Провигила у смањењу прекомерне поспаности утврђена је у следећем сну поремећаји: нарколепсија, опструктивна апнеја за вријеме спавања / синдром хипопнеје (ОСАХС) и поремећај спавања током радног времена (СВСД).
Нарколепсија
У две америчке деветонедељне недеље утврђена је ефикасност Провигила у смањењу прекомерне поспаности (ЕС) повезане са нарколепсијом, вишецентрична, плацебо-контролисана, двострука доза (200 мг дневно и 400 мг дневно), паралелно-групна, двоструко слепа испитивања амбулантних болесника Критеријуми за нарколепсију (ИЦД-9 и Америчко удружење за поремећаје спавања) (који су такође у складу са Америчким психијатријским удружењем) ДСМ-ИВ критеријуми). Ови критеријуми укључују или: 1) понављајуће дневне навале или нестанке у сну који се јављају скоро свакодневно током најмање три месеца, плус изненадни билатерални губитак постуралног мишићног тонуса у вези са интензивном емоцијом (катаплексија) или 2) жалба због прекомерне поспаности или изненадна слабост мишића са пратећим карактеристикама: парализа спавања, хипнагогичне халуцинације, аутоматско понашање, поремећен главни сан епизода; и полисомнографија која показује једно од следећег: латенција спавања мања од 10 минута или брзо кретање ока (РЕМ) латенција сна мање од 20 минута. Поред тога, за улазак у ове студије, сви су пацијенти морали објективно документовати прекомерну дневну поспаност, вишеструки сан Латенци Тест (МСЛТ) са два или више РЕМ периода спавања и одсуством било којег другог клинички значајног активног медицинског или психијатријског поремећај. МСЛТ, објективна дневна полисомнографска процена пацијентове способности да заспи у нестимулирајућем стању околина, мери латенцију (у минутама) након почетка спавања у просеку током 4 сесије испитивања у интервалима од 2 сата након ноћног боравка полисомнографија. За свако испитивање, субјекту је речено да мирно лежи и покушава да заспи. Свака тест сесија прекинута је након 20 минута ако није дошло до спавања или 15 минута након почетка спавања.
У обе студије су примарне мере делотворности биле 1) латенција спавања, процењена тестом одржавања будности (МВТ) и 2) промене у укупном статусу болести пацијента, мерено клиничким глобалним утиском промене (ЦГИ-Ц). За успешно суђење обе мере морале су да покажу значајно побољшање.
МВТ мери латенцију (у минутима) након почетка спавања у просеку током 4 сесије испитивања у интервалима од 2 сата након ноћне полисомнографије. За свако тестирање од испитаника се тражило да остане будан без употребе ванредних мера. Свака тест сесија прекинута је након 20 минута ако се није спавало или 10 минута након почетка спавања. ЦГИ-Ц је скала од 7 тачака, усредсређена на Без промене и креће се од веома пуно горег до веома побољшаног. Процењиваче су оцењивали пацијенти који нису имали приступ било каквим подацима о пацијентима осим мерила њихове озбиљности. Оцењивачима нису дата никаква конкретна упутства о критеријумима које су требали применити приликом оцењивања пацијената.
Остале процене ефекта обухватале су вишеструки тест латенције спавања (МСЛТ), Епвортх-ову лествицу слености (ЕСС; низ питања која су конципирана за процену степена поспаности у свакодневним ситуацијама) Стеер Цлеар Перформанце Перформанце (СЦПТ; рачунарско заснована процена пацијентове способности да избегне налет на препреке у симулираној ситуацији вожње), стандардна ноћна полисомнографија и пацијентов дневни дневник спавања. Пацијенти су такође оцењени на скали квалитета живота у нарколепсији (КОЛИН), која садржи потврђени здравствени упитник СФ-36.
Обе студије су показале побољшање објективних и субјективних мера прекомерне дневне поспаности за дозе од 200 мг и 400 мг у поређењу са плацебом. Пацијенти лечени било којом дозом Провигил-а показали су статистички значајно повећану способност да остане будан на МВТ (све п вредности <0,001) на недеље 3, 6, 9 и последњу посету у поређењу са плацебом и статистички значајно веће глобално побољшање, оцењено на ЦГИ-Ц скали (све п вредности <0.05).
Просечне латенције спавања (у минутама) на МВТ-у на почетној линији за 2 контролисана испитивања приказане су у Табели 1 испод, заједно са просечном променом од основне линије на МВТ-у на крају посете.
Проценти пацијената који су показали било који степен побољшања на ЦГИ-Ц у два клиничка испитивања приказани су у Табели 2 испод.
Слична статистички значајна побољшања везана за третман примећена су и на другим мерама умањења у нарколепсија, укључујући пацијента процењену ниво дневне поспаности на ЕСС (п <0,001 за сваку дозу у поређењу са плацебо).
Употреба Провигила није утицала на ноћни сан мерен полисомнографијом.
Синдром опструктивне апнеје за вријеме спавања / хипопнеје (ОСАХС)
У две клиничке студије утврђена је ефикасност Провигила у смањењу прекомерне поспаности повезане са ОСАХС. У обе студије су укључени пацијенти који су задовољили Међународну класификацију поремећаја спавања (ИЦСД) критеријуми за ОСАХС (који су такође у складу са Америчким психијатријским удружењем ДСМ-ИВ критеријуми). Ови критеријуми укључују или: 1) претерану поспаност или несаницу, плус честе епизоде оштећења дисање током сна и придружене функције као што су гласно хркање, јутарња главобоља и суха уста буђење; или 2) прекомерна поспаност или несаница и полисомнографија која показују једно од следећег: више од пет опструктивних апнеја, свака дужина дуже од 10 секунди, на сат сна и једно или више од следећег: учестала узбуђења због спавања која су повезана са апнејама, брадитахикардијом и десатурацијом артеријског кисеоника у вези са апнеја. Поред тога, за улазак у ове студије требало је да сви пацијенти имају прекомерну поспаност, што је показано са оценом 10 он на скали лежања Епвортх-а, упркос лечењу са сталним позитивним притиском у дисајним путевима (ЦПАП). Доказ да је ЦПАП био ефикасан у смањењу епизода апнеје / хипопнеје, потребан је заједно са документацијом о употреби ЦПАП-а.
У првом истраживању, у 12-недељном мултицентричном плацебо контролираном испитивању, укупно је 327 пацијената рандомизирано да су примали 200 мг провигил-а дневно, Провигил 400 мг / дан или одговарајући плацебо. Већина пацијената (80%) била је у потпуности у складу са ЦПАП-ом, дефинисаним као употреба ЦПАП-а> 4 сата / ноћи на> 70% ноћи. Остатак је делимично у складу са ЦПАП, дефинисан као ЦПАП коришћење 30% ноћења. Употреба ЦПАП-а настављена је током читаве студије. Примарне мере ефикасности биле су 1) латенција спавања, процењена тестом одржавања будности (МВТ) и 2) промена у укупном статусу болести пацијента, измерена клиничким глобалним утиском промене (ЦГИ-Ц) у 12. или завршној недељи посета. (Види Цлиницал Траилс, Одељак за нарколепсију за опис ових тестова.)
Пацијенти лечени Провигил-ом показали су статистички значајно побољшање способности за остати будан у поређењу са пацијентима који су примали плацебо, мерено МВТ (п <0,001) у крајњој тачки [Табела 1]. Пацијенти који су лечени провигилом такође су показали статистички значајно побољшање клиничког стања које је оцењено ЦГИ-Ц скалом (п <0,001) [Табела 2]. Две дозе Провигил-а изведене су слично.
У другом истраживању, четвонедељном мултицентричном плацебо контролираном испитивању, 157 пацијената је насумично рађено на 400 мг / дан или плацебо Провигил. Документација о редовној употреби ЦПАП-а (најмање 4 сата / ноћи у 70% ноћи) била је потребна за све пацијенте. Примарна мера исхода била је промена са почетне вредности на ЕСС-у током 4. недеље или коначна посета. Основни ЕСС резултати за Провигил и плацебо групе били су 14,2 и 14,4, респективно. У 4. недељи, ЕСС је смањен за 4,6 у групи Провигил и за 2,0 у групи са плацебом, разлика која је била статистички значајна (п <0,0001).
Употреба Провигила није утицала на ноћни сан мерен полисомнографијом.
Схифт поремећај спавања током рада (СВСД)
Ефикасност Провигила за прекомерно поспаност повезано са СВСД-ом доказана је у 12-недељном клиничком испитивању плацебом. Укупно 209 пацијената са хроничним СВСД-ом је насумично одабрано да примају Провигил 200 мг / дан или плацебо. Сви пацијенти су испунили критеријуме за хронични СВСД (који су Међународни класификацији поремећаја спавања (ИЦСД-10)) у складу са критеријумима ДСМ-ИВ америчке асоцијације за психијатрију за поремећај спавања у циркадијанском ритму: смена Тип). Ови критеријуми укључују 1) било: а) примарну жалбу због прекомерне поспаности или несанице која је временски повезана са радним временом (обично ноћним радом) који настаје током фазе уобичајеног спавања или б) полисомнографија и МСЛТ показују губитак нормалног узорка спавања-будности (тј. поремећен хронобиолошки ритмичност); и 2) симптоми не представљају било који други медицински или ментални поремећај и 3) симптоми не испуњавају критеријуме за било који други поремећај спавања који производи несаницу или претерану поспаност (нпр. промена временске зоне [јет лаг] синдром).
Треба напоменути да нису сви пацијенти који се жале на поспаност који су такође ангажовани у сменама, не испуњавају критеријуме за дијагнозу СВСД-а. У клиничко испитивање, укључени су само пацијенти који су били симптоматски најмање 3 месеца.
Уписани пацијенти су такође морали да раде најмање 5 ноћних смена месечно и имају прекомерну поспаност време њихове ноћне смене (МСЛТ оцена <6 минута), а дневну несаницу документује дневни полисомнограм (ПСГ).
Примарне мере ефикасности биле су 1) латенција спавања, процењена Мултипле Латенци Тест (МСЛТ) током симулиране ноћне смене у 12. недељи или последња посета и 2) промена целокупног статуса болести, мерено Клиничким глобалним утиском промене (ЦГИ-Ц) у 12. недељи или последњем посета. Пацијенти лечени Провигилом показали су статистички значајно продужено време почетка спавања у поређењу са пацијентима који су лечени плацебом, мерено ноћним МСЛТ-ом [Табела 1] (п <0,05). Такође је опажено да је побољшање на ЦГИ-Ц статистички значајно (п <0,001). (Види Цлиницал Траилс, Одељак за нарколепсију за опис ових тестова.)
Дневни сан мерен полисомнографијом није утицао на употребу Провигила.
ХТМЛ међуспремник
| Поремећај | Мерите | Провигил 200 мг * |
Провигил 400 мг * |
Плацебо | |||
| * Значајно различит од плацеба за сва испитивања (п <0,01 за сва испитивања, осим СВСД, која је била п <0,05) | |||||||
| Основна линија | Промена од Основне линије |
Основна линија | Промена од Основне линије |
Основна линија | Промена са Основна линија |
||
| Нарколепсија И | МВТ | 5.8 | 2.3 | 6.6 | 2.3 | 5.8 | -0.7 |
| Нарколепсија ИИ | МВТ | 6.1 | 2.2 | 5.9 | 2.0 | 6.0 | -0.7 |
| ОСАХС | МВТ | 13.1 | 1.6 | 13.6 | 1.5 | 13.8 | -1.1 |
| СВСД | МСЛТ | 2.1 | 1.7 | - | - | 2.0 | 0.3 |
| Поремећај | Провигил 200 мг * |
Провигил 400 мг * |
Плацебо |
| * Значајно другачији од плацеба за сва испитивања (п <0,01) | |||
| Нарколепсија И | 64% | 72% | 37% |
| Нарколепсија ИИ | 58% | 60% | 38% |
| ОСАХС | 61% | 68% | 37% |
| СВСД | 74% | - | 36% |
врх
Индикације и употреба
Провигил је индициран да побољшава будност код одраслих пацијената са прекомерном поспаношћу повезаном са нарколепсијом, опструктивном апнејом за вријеме спавања / хипопнејом и поремећајем спавања код радног спавања.
У ОСАХС-у, Провигил је означен као додатак стандардном третману за основну опструкцију. Ако је континуирани позитивни притисак у дисајним путевима (ЦПАП) избор лечења за пацијента, потребно је уложити максималан напор да се лечи ЦПАП адекватно време пре него што се започне са лечењем Провигил-ом. Ако се Провигил користи адекватно са ЦПАП-ом, неопходно је охрабривање и периодична процена усаглашености са ЦПАП-ом.
У свим случајевима пажљива пажња на дијагнози и лечењу основних поремећаја спавања је од највеће важности. Прописници треба да буду свесни да неки пацијенти могу имати више поремећаја спавања што доприноси њиховој прекомерној поспаности.
Ефикасност модафинила у дугорочној употреби (већа од 9 недеља у клиничким испитивањима нарколепсије и 12 недеља у клиничким испитивањима ОСАХС и СВСД) није систематски процењивана у плацебо-контролираном суђења. Лекар који се одлучи да пропише Провигил дуже време пацијентима са Нарколепсијом, ОСАХС или СВСД, треба периодично да преиспита дугорочну корисност за појединог пацијента.
врх
Контраиндикације
Провигил је контраиндициран код пацијената са познатом преосетљивошћу на модафинил, армодафинил или његове неактивне састојке.
врх
Упозорења
Озбиљан осип, укључујући Стевенс-Јохнсонов синдром
Описани су озбиљни осипи који захтевају хоспитализацију и прекид лечења код одраслих и деце у комбинацији са применом модафинила.
Модафинил није одобрен за употребу код педијатријских пацијената ни за једну индикацију.
У клиничким испитивањима модафинила инциденција осипа која је резултирала престанком узимања била је приближно 0,8% (13 на 1.585) код педијатријских болесника (старосна доб <17 година); ови осипи укључују 1 случај могућег Стевенс-Јохнсонова синдрома (СЈС) и 1 случај очигледне реакције преосјетљивости на више органа. Неколико случајева је било повезано са врућицом и другим абнормалностима (нпр. Повраћањем, леукопенијом). Медијан времена до осипа који је имао за последицу прекид био је 13 дана. Нису забележени такви случајеви код 380 педијатријских пацијената који су примали плацебо. У клиничким испитивањима за одрасле (0 на 4.264) модафинила није забележен озбиљан осип на кожи.
Ретки случајеви озбиљних или опасних по живот осипа, укључујући СЈС, токсичну епидермалну некролизу (ТЕН) и лек осип са Забиљежени су еозинофилија и системски симптоми (ДРЕСС) код одраслих и дјеце током свјетског пост-стављања на тржиште искуство. Стопа пријављивања ТЕН и СЈС повезана са применом модафинила, за коју се општеприхвата да је потцењена због слабе пријаве, прелази стопу учесталости у позадини. Процене стопе инциденције у позадини ових озбиљних кожних реакција у општој популацији крећу се од 1 до 2 случаја на милион људи годишње.
Не постоје фактори за које се зна да предвиђају ризик од појаве или тежину осипа повезаних са модафинил-ом. Скоро сви случајеви озбиљног осипа повезаних са модафинилом појавили су се у року од 1 до 5 недеља након започињања лечења. Међутим, забележени су изоловани случајеви после дужег лечења (нпр. 3 месеца). Сходно томе, трајање терапије не може се ослонити на средство за предвиђање потенцијалног ризика који је наговештен првом појавом осипа.
Иако се бенигни осип појављује и код модафинила, није могуће поуздано предвидјети који ће се осипи показати озбиљним. Сходно томе, модафинил обично треба обуставити код првих знакова осипа, осим ако осип очигледно није повезан са леком. Прекид лечења не може спречити да осип постане опасан по живот или га трајно онеспособи или изобличи.
Ангиоедем и анафилактоидне реакције
Један озбиљан случај ангиоедема и један случај преосетљивости (са осипом, дисфагијом и бронхоспазмом) су примећен међу 1595 пацијената лечених армодафинилом, Р енантиомером модафинила (који је рацемични смеша). Нису забележени такви случајеви у клиничким испитивањима модафинила. Међутим, забиљежен је ангиоедем у искуству постмаркетиншког лијека са модафинилом. Пацијентима треба саветовати да прекину са терапијом и одмах јаве свом лекару било какве знакове или симптоми који сугеришу ангиоедем или анафилаксију (нпр. отицање лица, очију, усана, језика или гркљан; потешкоће у гутању или дисању; промуклост).
Реакције преосјетљивости на више органа
Реакције преосјетљивости на више органа, укључујући барем један смртни случај у постмаркетиншком искуству, имају настао у блиској временској асоцијацији (средње време до откривања 13 дана: распон 4-33) до почетка модафинил.
Иако је било ограниченог броја извештаја, реакције преосјетљивости на више органа могу резултирати хоспитализацијом или бити опасне по живот. Не постоје фактори за које се зна да предвиђају ризик од појаве или озбиљност мулти-органских реакција преосјетљивости повезаних са модафинилом. Знакови и симптоми овог поремећаја били су различити; међутим, пацијенти се обично, иако не искључиво, јављају са грозницом и осипом повезаним са укљученошћу других органских система. Остале придружене манифестације укључују миокардитис, хепатитис, абнормалности испитивања функције јетре, хематолошке абнормалности (нпр. еозинофилија, леукопенија, тромбоцитопенија), пруритус и астенија Како је преосјетљивост на више органа различита у својој експресији, могу се појавити и други симптоми и знакови органских система који овдје нису примијећени.
Ако се сумња на реакцију преосјетљивости на више органа, лијек Провигил треба прекинути. Иако нема извештаја о случајевима који указују на унакрсну осетљивост на друге лекове који производе овај синдром, искуство са лековима повезаним са преосјетљивости на више органа показало би да је ово а могућност.
Стална поспаност
Пацијентима са ненормалним нивоом поспаности који узимају Провигил треба упутити пажњу да се ниво будности можда неће вратити у нормалу. Пацијенте са прекомерном поспаношћу, укључујући и оне који узимају Провигил, треба често оцењивати степен поспаности и, ако је прикладно, саветује се избегавање вожње или било које друге потенцијално опасне активности. Прописници такође требају бити свјесни да пацијенти не могу признати поспаност или поспаност док се директно не поставе питања о поспаности или поспаности током одређених активности.
Психијатријски симптоми
Забиљежена су психијатријска нежељена искуства код пацијената лијечених модафинилом. Неповољни догађаји који су повезани са употребом модафинила били су обухваћени манијом, заблудама, халуцинацијама, самоубилачком идејом и агресијом, од којих неки резултирају хоспитализацијом. Многи, али не сви, пацијенти су имали претходну психијатријску анамнезу. Један здрав мушкарац добровољац развио је идеје референцирања, параноидне заблуде и слушне халуцинације у вези са вишеструким дневним дозама модафинила од 600 мг и недостатком сна. Није било доказа о психози 36 сати након престанка узимања лекова.
У бази података о испитивањима модафинила код одраслих психијатријски симптоми који су резултирали прекидом лијечења (на фреквенцији> 0,3%) и чешће пријављени код пацијената лечени модафинилом у поређењу са онима који су лечени плацебом били су анксиозност (1%), нервоза (1%), несаница (<1%), конфузија (<1%), узнемиреност (<1%) и депресија (<1%). Опрез треба бити опрезан када се Провигил даје пацијентима који имају историју психозе, депресије или маније. Треба размотрити могућу појаву или погоршање психијатријских симптома код пацијената лечених провигилом. Ако се психијатријски симптоми развију заједно са применом Провигила, размислите о прекиду употребе Провигила.
врх
Мере предострожности
Дијагноза поремећаја спавања
Провигил треба користити само код пацијената који су имали потпуну процену прекомерне поспаности и код којих дијагноза или нарколепсије, ОСАХС и / или СВСД је постављена у складу са дијагностичким критеријумима ИЦСД или ДСМ (види Цлиницал Траилс). Таква евалуација се обично састоји од комплетне анамнезе и физичког прегледа, а може се надопунити и тестирањем у лабораторијским условима. Неки пацијенти могу имати више од једног поремећаја спавања што доприноси њиховој прекомерној поспаности (нпр. ОСАХС и СВСД се подударају код истог пацијента).
Генерал
Иако није доказано да модафинил производи функционално оштећење, било који лек који утиче на ЦНС може изменити просудбу, мишљење или моторичке способности. Пацијенте треба упозорити на употребу аутомобила или других опасних машина док их не постану са оправданом сигурношћу да терапија Провигил-ом неће негативно утицати на њихову способност да се укључе у такво активности.
Употреба ЦПАП-а код пацијената са ОСАХС-ом
У ОСАХС-у, Провигил је означен као додатак стандардном третману за основну опструкцију. Ако је континуирани позитивни притисак у дисајним путевима (ЦПАП) избор лечења за пацијента, потребно је уложити максималан напор да се лечи ЦПАП адекватно време пре него што се започне са лечењем Провигил-ом. Ако се Провигил користи адекватно са ЦПАП-ом, неопходно је охрабривање и периодична процена усаглашености са ЦПАП-ом.
Кардиоваскуларни систем
Модафинил није процењен код пацијената са недавном историјом инфаркта миокарда или нестабилном ангином, и према тим пацијентима треба поступати опрезно.
У клиничким студијама Провигила, знакови и симптоми, укључујући бол у грудима, палпитације, диспнеју и пролазну исхемију Промене Т-таласа на ЕКГ-у примећене су код три испитаника у вези са пролапсом митралног залиска или левом вентрикулом хипертрофија. Препоручује се да се Провигил таблете не користе код пацијената са хипертрофијом леве коморе у анамнези или пацијенти са пролапсом митралне заклопке који су доживели синдром пролапса митралног залиска приликом раније примања ЦНС-а стимулансе. Такви знакови могу укључивати, али нису ограничени на, исхемијске промене ЕКГ-а, бол у грудима или аритмију. Ако се појави било који од ових симптома, размотрите кардиолошку процену.
Праћење крвног притиска у краткотрајним (<3 месеца) контролисаним испитивањима није показало клинички значајне резултате промене средњег систолног и дијастоличког крвног притиска код пацијената који су примали Провигил у поређењу са плацебо. Међутим, ретроспективна анализа употребе антихипертензивних лекова у овим студијама показала је да је већи део лекова пацијентима који су узимали Провигил потребна је нова или повећана употреба антихипертензивних лекова (2,4%) у поређењу са пацијентима који су узимали плацебо (0,7%). Диференцијална употреба је била нешто већа када су укључене само студије у ОСАХС, на 3,4% пацијената Провигил и 1,1% пацијената који су узимали плацебо и захтевали такве промене у употреби антихипертензива лекови. Појачан надзор крвног притиска може бити прикладан код пацијената на Провигил-у.
Пацијенти који користе стероидне контрацептиве
Ефикасност стероидних контрацептива може се смањити ако се примењује са Провигил таблетама и месец дана након прекида терапије (видети Мере предострожности, Интеракције лијекова). Алтернативне или сувремене методе контрацепције препоручују се пацијентима који су лечени таблетама Провигил и месец дана након прекида употребе Провигила.
Пацијенти који користе циклоспорин
Ниво циклоспорина у крви може се смањити ако се користи са Провигил-ом (види Мере предострожности, Интеракције лијекова). Када се ти лекови користе истодобно, треба размотрити надгледање концентрација циклоспорина у циркулацији и одговарајуће прилагођавање дозе за циклоспорин.
Пацијенти с тешком оштећењем јетре
У болесника са тешким оштећењем јетре, са или без цирозе (види Клиничка фармакологија), Провигил треба давати у смањеној дози (види Дозирање и администрација).
Пацијенти са озбиљним оштећењем бубрега
Не постоје адекватне информације за утврђивање сигурности и ефикасности дозирања код пацијената са тешким оштећењем бубрега. (За фармакокинетику код оштећења бубрега, види Клиничка фармакологија.)
Старији пацијенти
Код старијих пацијената елиминација модафинила и његових метаболита може бити смањена као последица старења. Стога би требало размотрити употребу нижих доза код ове популације. (Види Клиничка фармакологија и Дозирање и администрација).
Информације за пацијенте
Лекарима се саветује да следећа питања разговарају са пацијентима којима преписују Провигил.
Провигил је индициран за пацијенте који имају ненормалне нивое поспаности. Показано је да провигил побољшава, али не и елиминира ову ненормалну тенденцију да се заспи. Стога пацијенти не би требало да мењају своје претходно понашање у вези са потенцијално опасним активностима (нпр. Вожња, управљање машинама) или другим активности које захтевају одговарајуће нивое будности, све док и ако се не покаже да лечење Провигил-ом ствара ниво будности који то дозвољава активности. Пацијентима треба упутити пажњу да Провигил није замена за сан.
Пацијенте треба обавијестити да је од пресудне важности да наставе са претходно прописаним третманима (нпр. Пацијенти са ОСАХС који примају ЦПАП и даље то раде).
Пацијенте треба информисати о доступности упутства за добијање пацијента и упутити их да прочитају летак пре узимања Провигила.
Пацијенте треба саветовати да се обрате свом лекару ако осећају бол у грудима, осип, депресију, анксиозност или знаке психозе или маније.
Трудноћа
Пацијентима треба упутити да обавештавају свог лекара ако затрудне или намеравају да затрудне током терапије. Пацијенте треба упозорити на потенцијални повећани ризик од трудноће када користе стероидне контрацептиве (укључујући депо или имплантабилно контрацептива) са Провигил-ом и током месец дана након прекида терапије (видети канцерогенеза, мутагенеза, оштећење плодности и Трудноћа).
Нега
Пацијенткиње би требало савјетовати да обавијесте свог љекара ако доје дијете.
Истодобни лекови
Пацијенте треба саветовати да обавештавају свог лекара ако узимају или планирају да узму било шта лекова који се издају на рецепт или без рецепта, због потенцијала за интеракцију између Провигила и други лекови.
Алкохол
Пацијенте треба упутити да примена Провигила у комбинацији са алкохолом није проучавана. Пацијенте треба упутити да је опрезно избегавати алкохол док узимају Провигил.
Алергијске реакције
Пацијенте треба саветовати да престану да узимају Провигил и да обавештавају свог лекара ако се појави осип, копривницу, чиреве на устима, жуљеве, љуштење коже, проблеме са гутањем или дисањем или сродну алергију појава.
Интеракције са лековима
ЦНС-активни лекови
Метилфенидат
У студији са једном дозом код здравих добровољаца, истодобна примена модафинила (200 мг) са метилфенидат (40 мг) није изазвао значајне промене у фармакокинетикама ниједног од њих лек. Међутим, апсорпција Провигила може се одложити за отприлике један сат када се примени заједно са метилфенидатом.
У истраживању са више доза, у стању стабилног стања код здравих добровољаца, модафинил се примењивао једном дневно у 200 мг / дан током 7 дана, а затим 400 мг / дан током 21 дана. Давање метилфенидата (20 мг / дан) током дана 22-28 дана лечења модафинилом 8 сати после дневна доза модафинила није проузроковала значајне промене у фармакокинетикама лекова модафинил.
Декстроамфетамин
У студији са једном дозом код здравих добровољаца, истодобна примена модафинила (200 мг) са декстроамфетамин (10 мг) није изазвао значајне промене у фармакокинетикама ниједног од њих лек. Међутим, апсорпција Провигила може се одложити за отприлике један сат када се примени заједно са декстроамфетамином.
У истраживању са више доза, у стању стабилног стања код здравих добровољаца, модафинил се примењивао једном дневно у 200 мг / дан током 7 дана, а затим 400 мг / дан током 21 дана. Примена декстроамфетамина (20 мг / дан) током дана 22-28 дана лечења модафинилом 7 сати после дневна доза модафинила није проузроковала значајне промене у фармакокинетикама лекова модафинил.
Кломипрамин
Истодобна примена једне дозе кломипрамина (50 мг) првог од три дана лечења модафинил (200 мг / дан) код здравих добровољаца није показао ефекат на фармакокинетику било ког лека. Међутим, забележен је један инцидент повећаног нивоа кломипрамина и његовог активног метаболита десметил-кломипрамина код пацијента са нарколепсијом током лечења модафинилом.
Триазолам
У студији интеракције лекова између Провигил-а и етил-естрадиола (ЕЕ2), истих дана као и узорковање плазме за фармакокинетику ЕЕ2, такође је примењена појединачна доза триазолама (0,125 мг). Средња вредност Цмак и АУЦ0-β триазолама смањена је за 42% и 59%, респективно, а њен полуживот елиминације смањен је отприлике сат времена након третмана модафинил-ом.
Инхибитори моноамин оксидазе (МАО)
Студије интеракције са инхибиторима моноамин оксидазе нису спроведене. Због тога треба бити опрезан код истодобне примене МАО инхибитора и модафинила.
Остали лекови
Варфарин
Није било значајних промена у фармакокинетичким профилима Р- и С-варфарина код здравих особа које су давале једну дозу рацемског варфарина (5 мг) након хроничне примјене модафинила (200 мг / дан током 7 дана, а затим 400 мг / дан током 27 дана) у односу на профиле испитаника плацебо. Међутим, чешће праћење времена протромбина / ИНР је препоручљиво кад год се Провигил примењује заједно са варфарином (види Клиничка фармакологија, Фармакокинетика, интеракције између лекова и лекова).
Етхинил Естрадиол
Давање модафинила женама добровољцима једном дневно, у дози од 200 мг / дан током 7 дана, а затим 400 мг / дан током 21 дана резултирало је средњим падом Цмак од 11%, а смањењем АУЦ0-24 етинил естрадиола за 18% (ЕЕ2; 0,035 мг; примењено орално са норгестимате). Није било очигледних промена у стопи елиминације етинил естрадиола.
Циклоспорин
Забиљежен је један случај интеракције између модафинила и циклоспорина, супстрата ЦИП3А4, код 41-годишње жене која је била подвргнута трансплантацији органа. Након месец дана примене 200 мг модафинила на дан, ниво циклоспорина у крви смањен је за 50%. Поступак интеракције је последица појачаног метаболизма циклоспорина, јер ниједан други фактор за који се очекује да утиче на диспозицију лека се није променио. Можда ће бити потребно прилагођавање дозе за циклоспорин.
Потенцијалне интеракције са лековима који инхибирају, изазивају или се метаболишу помоћу изоензима цитокрома П-450 и других јетрених ензима
У ин витро студијама које су користиле примарне хумане хепатоцитне културе, показано је да модафинил благо индукује ЦИП1А2, ЦИП2Б6 и ЦИП3А4 на начин зависан од концентрације. Иако резултати индукције засновани на ин витро експериментима нису предиктивни предиктивни одговор ин виво, опрез треба примењивати кад се Провигил примењује заједно са лековима који зависе од ова три ензима одобрење. Тачније, нижи нивои таквих лекова у крви могу да резултирају (види Остали лекови, циклоспоринеа горе).
Изложеност хуманих хепатоцита модафинилу ин витро изазвала је очигледно концентрисано сузбијање експресије активности ЦИП2Ц9 сугерише да постоји потенцијал за метаболичку интеракцију између модафинила и супстрата овог ензима (нпр., С-варфарин и фенитоин). У каснијој клиничкој студији код здравих добровољаца, лечење хроничним модафинилом није показало значајан ефекат на фармакокинетику варфарина од једне дозе у поређењу са плацебом (видети Мере предострожности, Интеракције лијекова, Варфарин).
Испитивања ин витро употребом хуманих микросома јетре показала су да модафинил реверзибилно инхибира ЦИП2Ц19 у фармаколошки релевантним концентрацијама модафинила. ЦИП2Ц19 је такође реверзибилно инхибиран, са сличном потенцијом, циркулирајућим метаболитом, модафинил сулфоном. Иако су максималне концентрације модафинил сулфона у плазми много ниже од матичних модафинил, комбиновани ефекат оба једињења може произвести трајну делимичну инхибицију ензим. Лијекови који се у великој мјери елиминишу путем метаболизма ЦИП2Ц19, попут диазепама, пропранолола, фенитоина (такође путем ЦИП2Ц9) или С-мефенитоин може да има продужену елиминацију након истодобне примене Провигила и може да захтева смањење дозе и праћење дозе за токсичност.
Трициклички антидепресиви
ЦИП2Ц19 такође пружа помоћни пут за метаболизам одређених трицикличких антидепресива (нпр., Кломипрамина и десипрамина) који се примарно метаболишу помоћу ЦИП2Д6. У трициклички лечених болесника са мањком ЦИП2Д6 (тј. Код оних који су лоши метаболизатори дебрисокуина; 7-10% становништва Кавказа; слично или ниже код других популација), количина метаболизма помоћу ЦИП2Ц19 може се значајно повећати. Провигил може узроковати повишење нивоа трициклица у овој подскупини пацијената. Лекари треба да буду свесни да ће овим пацијентима бити потребно смањење дозе трицикличких средстава.
Поред тога, због делимичног учешћа ЦИП3А4 у метаболичком уклањању модафинила, истодобна примена моћних индуктора ЦИП3А4 (нпр. карбамазепин, фенобарбитал, рифампин) или инхибитори ЦИП3А4 (нпр. кетоконазол, итраконазол) могу променити ниво у плазми од модафинил.
Канцерогенеза, мутагенеза, оштећење плодности
Карциногенеза
Обављене су студије канцерогености у којима се модафинил давао у исхрани мишевима током 78 недеља, а штакорима 104 недеље, у дозама од 6, 30 и 60 мг / кг / дан. Највећа испитивана доза је 1,5 (миш) или 3 (пацов) пута већа од препоручене дневне дозе модафинила (200 мг) за одрасле људе на бази мг / м2. У овим студијама није било доказа о туморигенези повезаној са применом модафинила. Међутим, пошто је у мишјем испитивању коришћена неадекватна висока доза која није била репрезентативна за максималну толерисану дозу, накнадна студија канцерогености је спроведена у Тг. АЦ трансгени миш. Дозе процењене у Тг. АЦ испитивање је било 125, 250 и 500 мг / кг / дан, дермално давано. Није било доказа о туморигености повезаној са применом модафинила; међутим, овај дермални модел можда неће адекватно проценити канцерогени потенцијал орално примењеног лека.
Мутагенеза
Модафинил није показао мутагени или кластогени потенцијал у низу ин витро (тј. Тест бактеријске реверзне мутације, тест мишјег лимфома тк, хромозомска аберација тест на хумане лимфоците, тест ћелијске трансформације у БАЛБ / 3Т3 ћелијама мишјег ембриона) тест у одсуству или присуству метаболичке активације, или ин виво (микронуклеус коштане сржи миша) анализе. Модафинил је такође био негативан у ненапланираном тесту синтезе ДНК у хепатоцитима штакора.
Оштећење плодности
Орална примена модафинила (дозе до 480 мг / кг / дан) мужјацима и женкама пацова пре и током парење и настављање код женки до 7. дана гестације довело је до повећања времена парења на највишем доза; нису примећени ефекти на остале параметре плодности или репродуктивности. Доза без ефекта од 240 мг / кг / дан повезана је са изложеношћу модафинилу у плазми (АУЦ), приближно једнакој оној код људи у препорученој дози од 200 мг.
Трудноћа
Категорија Ц у трудноћи:
У студијама спроведеним на пацовима и зечевима, примећена је токсичност за развој код клинички релевантних изложености.
Модафинил (50, 100 или 200 мг / кг / дан) који се орално даје трудним пацовима током периода изазване органогенезе, у одсуству токсичност за мајку, повећање ресорпција и повећана инциденција висцералних и скелетних варијација код потомства на највишем доза. Већа доза без дејства за токсичност за развој ембриофеталних штакора била је повезана са плазмом изложеност модафинилу приближно 0,5 пута већа од АУЦ код људи при препорученој дневној дози (РХД) од 200 мг. Међутим, у каснијој студији до 480 мг / кг / дан (изложеност модафинилу у плазми, приближно 2 пута већој од АУЦ код људи у РХД) нису примећени штетни ефекти на развој ембриофетала.
Модафинил орално даван трудним зечевима током периода органогенезе у дозама од 45, 90 и 180 мг / кг / дан повећало је учесталост феталних структурних промјена и ембриофеталне смрти при највећој дози. Највећа доза без ефекта за токсичност за развој била је повезана са АУЦ модафинила у плазми, приближно једнаком АУЦ код људи у РХД.
Орална примена армодафинила (Р-енантиомер модафинила; 60, 200 или 600 мг / кг / дан) трудничким пацовима током периода органогенезе резултирало повећаним штетностима феталне висцералне и скелетне варијације у прелазној дози или веће и смањене тежине феталног тела доза. Доза без ефекта на ембриофеталну токсичност за развој пацова била је повезана са армодинафилом у плазми изложеност (АУЦ) отприлике једну десетину више од АУЦ армодинафинила код људи лечених модафинилом на РХД.
Давање модафинила пацовима током трудноће и дојења оралним дозама до 200 мг / кг / дан резултира смањењем виталност потомства у дозама већим од 20 мг / кг / дан (АУЦ модафинил у плазми приближно 0,1 пута већи од АУЦ код људи при РХД). Нису примећени ефекти на постнатални развојни и неуробехевиорални параметар код преживелог потомства.
Не постоје адекватне и добро контролисане студије на трудницама. Забиљежена су два случаја интраутериног застоја раста и један случај спонтаног побачаја у комбинацији са армодафинилом и модафинилом. Иако фармакологија модафинила и армодафинила није идентична оној симпатомиметичких амина, они деле неке фармаколошке особине са овом класом. Неки од ових лекова повезани су са интраутериним успоравањем раста и спонтаним побачајима. Да ли су пријављени случајеви повезани са дрогом није познато.
Модафинил треба користити током трудноће само ако потенцијална корист оправдава потенцијални ризик за плод.
Рад и испорука
Утицај модафинила на порођај и порођај код људи није систематски истражен.
Неговане мајке
Није познато да ли се модафинил или његови метаболити излучују у мајчино млеко. Пошто се многи лекови излучују у људском млеку, треба бити опрезан када се Провигил таблете дају негованој жени.
Педијатријска употреба
Сигурност и ефикасност код педијатријских пацијената млађих од 16 година нису утврђени. Озбиљни кожни осипи, укључујући мултиформни еритемски главни (ЕММ) и Стевенс-Јохнсонов синдром (СЈС) повезани су са применом модафинила код педијатријских пацијената (види Упозорења, Озбиљан осип, укључујући Стевенс-Јохнсонов синдром).
У контролисаној недељној студији, 165 педијатријских пацијената (узраста 5-17 година) са нарколепсијом лечено је модафинилом (н = 123), или плацебом (н = 42). Није било статистички значајних разлика које су погодовале модафинилу над плацебом у продужењу латенције спавања мерено МСЛТ-ом, или у перцепцијама поспаности која је одређена на основу клиничке глобалне лекарске вредности (ЦГИ-Ц).
У контролисаним и отвореним клиничким студијама, лекови настају штетни догађаји психијатријског и нервног система укључују Тоуреттов синдром, несаницу, непријатељство, повећану катаплексију, повећане хипнагогичне халуцинације и самоубиствене идеја. Примећена је и пролазна леукопенија, која је решена без лекарске интервенције. У контролисаној клиничкој студији, 3 од 38 девојчица, старијих од 12 година, лечених модафинилом доживеле су дисменореју у поређењу са 0 од 10 девојчица које су примале плацебо.
Геријатријска употреба
Сигурност и ефикасност код особа старијих од 65 година нису утврђене. Искуство код ограниченог броја пацијената старијих од 65 година у клиничким испитивањима показало је учесталост нежељених искустава слична осталим старосним групама.
врх
Нежељене реакције
Модафинил је процењен на сигурност код преко 3500 пацијената, од којих више од 2000 пацијената са прекомерном тежином поспаност која је повезана са примарним поремећајима сна и будности дата је најмање једна доза модафинил. У клиничким испитивањима нађено је да се модафинил углавном добро подноси, а већина нежељених искустава била је блага до умерена.
Најчешће опажени нежељени догађаји (‰ ¥ 5%) повезани са применом Провигила чешће него пацијенти који су лечени плацебом код плацебо-контролисаних клиничке студије о примарним поремећајима сна и будности биле су главобоља, мучнина, нервоза, ринитис, пролив, бол у леђима, анксиозност, несаница, вртоглавица и диспепсија. Профил нежељених догађаја био је сличан у овим студијама.
У клиничким испитивањима која су контролисана плацебом, 74 од 934 пацијента (8%) који су примали Провигил прекинути су због негативног искуства у поређењу са 3% пацијената који су примали плацебо. Најчешћи разлози за прекид који су се појавили за Провигил са већом стопом од плацеба пацијенти су били главобоља (2%), мучнина, анксиозност, вртоглавица, несаница, бол у грудима и нервоза (сваки <1%). У канадском клиничком испитивању, 35-годишњи гојазни нарколептик с претходном историјом синкопалних епизода доживели су епизоду асистоле у трајању од 9 секунди након 27 дана лечења модафинилом (300 мг / дан подељено) дозе).
Инциденција у контролисаним испитивањима
Следећа табела (Табела 3) приказује негативна искуства која су се догодила брзином од 1% или више и која су била чешћа код одраслих пацијената лечених провигилом него у болесника који су лечени плацебом у главној, плацебо контролираној клиници суђења.
Прописивач треба да буде свјестан да доље приказане бројке не могу бити кориштене за предвиђање учесталости штетних искустава у током уобичајене медицинске праксе, где се карактеристике пацијента и други фактори могу разликовати од оних који се јављају током клиничке студије. Слично томе, цитиране фреквенције не могу се директно упоредити са подацима добивеним из других клиничких испитивања која укључују различите третмане, употребу или истраживаче. Преглед ових фреквенција, међутим, даје лекарима основу за процену релативног доприноса лекова и нелековних фактора у учесталости нежељених догађаја у испитиваној популацији.
| Систем тела | Преферред Терм | Модафинил (н = 934) |
Плацебо (н = 567) |
| * Шест двоструко слепих, плацебо-контролисаних клиничких студија о нарколепсији, ОСАХС и СВСД. 1 Укључени су догађаји најмање 1% пацијената лечених провигилом који су били чешћи него у групи са плацебом; учесталост је заокружена на најближих 1%. Терминологија негативног искуства кодирана је помоћу стандардног модификованог речника ЦОСТАРТ. Догађаји за које је инциденција Провигила била најмање 1%, али једнака или мања од плацеба, нису наведени у табели. Ови догађаји су укључивали следеће: инфекција, бол, случајне повреде, бол у трбуху, хипотермија, алергијска реакција, астенија, грозница, вирусна инфекција, бол у врату, мигрена, абнормални електрокардиограм, хипотензија, поремећај зуба, повраћање, пародонтални апсцес, повећан апетит, екхимоза, хипергликемија, периферни едем, губитак тежине, тежина добитак, мијалгија, грчеви ногу, артритис, катаплексија, неправилности у размишљању, поремећај спавања, појачан кашаљ, синуситис, диспнеја, бронхитис, осип, коњуктивитис, бол у уху, дисменореја4, инфекција уринарног тракта. 2 Повишени јетрени ензими. 3 Оро-фацијална дискинезија. 4 Инциденција прилагођена полу. | |||
| Тело као цело | Главобоља | 34% | 23% |
| Бол у леђима | 6% | 5% | |
| Синдром грипа | 4% | 3% | |
| Бол у грудима | 3% | 1% | |
| Прехлада | 1% | 0% | |
| Ригидност врата | 1% | 0% | |
| Кардиоваскуларни | Хипертензија | 3% | 1% |
| Тахикардија | 2% | 1% | |
| Палпитатион | 2% | 1% | |
| Вазодилатација | 2% | 0% | |
| Дигестиве | Мучнина | 11% | 3% |
| Пролив | 6% | 5% | |
| Диспепсија | 5% | 4% | |
| Сува уста | 4% | 2% | |
| Анорекиа | 4% | 1% | |
| Затвор | 2% | 1% | |
| Ненормална функција јетре2 | 2% | 1% | |
| Надимање | 1% | 0% | |
| Улцерација уста | 1% | 0% | |
| Жеђ | 1% | 0% | |
| Хемична / лимфна | Еозинофилија | 1% | 0% |
| Метаболички / Прехрамбени | Едема | 1% | 0% |
| Нервозан | Нервоза | 7% | 3% |
| Несаница | 5% | 1% | |
| Анксиозност | 5% | 1% | |
| Вртоглавица | 5% | 4% | |
| Депресија | 2% | 1% | |
| Парестезија | 2% | 0% | |
| Сомноленце | 2% | 1% | |
| Хипертонија | 1% | 0% | |
| Дискинезија3 | 1% | 0% | |
| Хиперкинезија | 1% | 0% | |
| Агитација | 1% | 0% | |
| Конфузија | 1% | 0% | |
| Тремор | 1% | 0% | |
| Емоционална лабилност | 1% | 0% | |
| Вертиго | 1% | 0% | |
| Респираторни | Ринитис | 7% | 6% |
| Фарингитис | 4% | 2% | |
| Поремећај плућа | 2% | 1% | |
| Епистакис | 1% | 0% | |
| Астма | 1% | 0% | |
| Кожа / Додаци | Знојење | 1% | 0% |
| Херпес Симплек | 1% | 0% | |
| Специјална чула | Амблиопиа | 1% | 0% |
| Абнормал Висион | 1% | 0% | |
| Окус перверзије | 1% | 0% | |
| Бол у оку | 1% | 0% | |
| Урогенитал | Ненормалност урина | 1% | 0% |
| Хематурија | 1% | 0% | |
| Пиуриа | 1% | 0% |
Зависност од нежељених догађаја од дозе
У клиничким испитивањима за одрасле који су контролисали плацебо, у којима су упоређене дозе од 200, 300 и 400 мг / дан Провигил и плацебо, једини нежељени догађаји који су били јасно повезани са дозом су главобоља и анксиозност.
Промене виталног знака
Иако није било конзистентних промена средњих вредности откуцаја срца или систоличког и дијастоличког крвног притиска, потреба за антихипертензивним лековима била је незнатно већа код пацијената на Провигилу у поређењу са плацебом (види Мере предострожности).
Промене тежине
Није било клинички значајних разлика у промени телесне тежине код пацијената лечених Провигил-ом у поређењу са пацијентима који су лечени плацебом у клиничким испитивањима која су контролисана плацебом.
Лабораторијске промене
Параметри клиничке хемије, хематологије и анализе мокраће праћени су у фазама 1, 2 и 3 испитивања. У овим истраживањима је утврђено да су средњи нивои гама глутамилтрансферазе (ГГТ) и алкалне фосфатазе (АП) виши након примене Провигила, али не и плацебо. Међутим, код неколико је субјеката дошло до пораста ГГТ или АП изван нормалног распона. Промена ка вишим, али не и клинички значајно ненормалним, чини се да ће се вредности ГГТ и АП повећавати с временом у популацији која је третирана Провигил-ом у клиничким испитивањима фазе 3. Нису уочене разлике у аланин аминотрансферази, аспартат аминотрансферази, укупном протеину, албумину или укупном билирубину.
ЕКГ промене
У клиничким испитивањима која су контролисана плацебом, након примене Провигила, није пронађен образац ЕКГ-а који је настао из лечења.
Постмаркетинг извјештаји
Следеће нежељене реакције идентификоване су током употребе Провигила након одобравања. Будући да се ове реакције добровољно пријављују из популације несигурне величине, није могуће поуздано проценити њихову учесталост или успоставити узрочно-посљедичну везу са излагањем лековима. Одлуке о укључивању ових реакција у обележавање обично се заснивају на једном или више следећих фактора: (1) озбиљност реакције, (2) учесталост извештавања или (3) јачина каузалне везе са Провигил.
Хематолошка: агранулоцитоза
врх
Злоупотреба и зависност од дрога
Класа контролисаних супстанци
Модафинил (Провигил) наведен је у Прилогу ИВ Закона о контролираним супстанцама.
Злоупотреба потенцијала и зависности
Провигил, поред свог ефекта повећања будности и повећања локомоторне активности код животиња, код људи психоактивни и еуфорични ефекти, промјене у расположењу, перцепцији, размишљању и осјећајима типичним за остале стимулансе ЦНС-а. У студијама везивања ин витро, модафинил се везује за место поновног уноса допамина и узрокује пораст ванћелијског допамина, али не повећава отпуштање допамина. Модафинил ојачава, о чему сведочи и његова самоуправа на мајмунима који су претходно обучени за самосталну примену кокаина. У неким студијама модафинил је такође делимично дискриминисан као подстицајан. Лекари требају пажљиво пратити пацијенте, посебно оне који имају историју злоупотребе дрога и / или стимуланса (нпр. Метилфенидата, амфетамина или кокаина). Пацијенте треба посматрати због знакова злоупотребе или злоупотребе (нпр. Повећање доза или понашање које тражи лек).
Потенцијал злоупотребе модафинила (200, 400 и 800 мг) процењен је у односу на метилфенидат (45 и 90 мг) у болничком испитивању код особа које су доживеле злоупотребу лекова. Резултати ове клиничке студије показали су да модафинил производи психоактивне и еуфоричне ефекте и осећаје који су у складу са осталим заказаним стимулансима ЦНС-а (метилфенидат).
Повлачење
Ефекти повлачења модафинила праћени су након 9 недеља употребе модафинила у једном америчком клиничком испитивању фазе 3. Током 14 дана посматрања нису примећени специфични симптоми одвикавања, мада се поспаност вратила код нарколептичких пацијената.
врх
Предозирање
Људско искуство
У клиничким испитивањима, укупно 151 доза спецификована протоколом у распону од 1000 до 1600 мг / дан (5 до 8 пута већа од препоручене дневне дозе од 200 мг) примењено је 32 испитаника, укључујући 13 испитаника који су примали дозе од 1000 или 1200 мг / дан током 7 до 21 узастопно дана. Поред тога, догодило се неколико намерних акутних предозирања; од којих су два највећа 4500 мг и 4000 мг узета од стране два испитаника који су учествовали у страним студијама депресије. Ниједан од ових испитаника није доживео никакве неочекиване или по живот опасне ефекте. Нежељена искуства која су пријављена у овим дозама укључују узбуђење или узнемиреност, несаницу и мала или умерена повишења хемодинамичких параметара. Остали посматрани ефекти високе дозе у клиничким студијама укључују анксиозност, раздражљивост, агресивност, конфузија, нервоза, тремор, палпитације, поремећаји сна, мучнина, пролив и смањен протромбин време.
Из искуства након стављања лијека у промет, није било извјештаја о смртним предозирањима која укључују само модафинил (дозе до 12 грама). Предозирање са више лекова, укључујући модафинил, резултирало је смртним исходом. Симптоми који најчешће прате предозирање модафинилом, сами или у комбинацији са другим лековима, укључују: несаницу; симптоми централног нервног система као што су немир, дезоријентација, збуњеност, узбуђење и халуцинације; пробавне промене као што су мучнина и пролив; и кардиоваскуларне промене као што су тахикардија, брадикардија, хипертензија и бол у грудима.
Забиљежени су случајеви случајног гутања / предозирања код дјеце у доби од 11 мјесеци. Највећи пријављени случајни унос на основи мг / кг догодио се код трогодишњег дечака који је уносио 800-1000 мг (50-63 мг / кг) модафинила. Дете је остало стабилно. Симптоми повезани са предозирањем код деце били су слични онима који су примећени код одраслих.
Управљање предозирањем
До данас није утврђен специфичан антидот токсичним ефектима предозирања модафинилом. Таквим предозирањем треба управљати првенствено подржавајућом негом, укључујући праћење кардиоваскуларног система. Ако нема контраиндикација, треба размотрити индуковану повраћање или испирање желуца. Нема података који би сугерисали корисност дијализе или закисељавања или алкализације мокраће у побољшању елиминације лекова. Лекар би требало да размотри контакт са центром за контролу отрова ради лечења предозирања.
врх
Дозирање и администрација
Препоручена доза Провигила је 200 мг која се даје једном дневно.
За пацијенте са нарколепсијом и ОСАХС, Провигил треба узимати у једној дози ујутру.
За пацијенте са СВСД-ом, Провигил треба узимати отприлике један сат пре почетка радне смене.
Дозе до 400 мг / дан, дане као једна доза, добро се толеришу, али нема конзистентних доказа да ова доза даје додатну корист изнад дозе од 200 мг (види Клиничка фармакологија и Цлиницал Траилс).
Општа разматрања
Потребно је узети у обзир прилагођавање дозе за истодобне лекове који су супстрати за ЦИП3А4, попут триазолама и циклоспорина (види Мере предострожности, Интеракције лијекова).
Лијекови који се у великој мјери елиминишу путем метаболизма ЦИП2Ц19, попут диазепама, пропранолола, фенитоина (такође путем ЦИП2Ц9) или С-мефенитоин може да има продужену елиминацију након истодобне примене Провигила и може да захтева смањење дозе и праћење дозе за токсичност.
Код пацијената са тешким оштећењем јетре, дозу Провигила треба смањити на половину дозе која се препоручује пацијентима са нормалном функцијом јетре (видети ЦКлиничка фармакологија и Мере предострожности).
Не постоје адекватне информације за утврђивање сигурности и ефикасности дозирања код пацијената са тешким оштећењем бубрега (види Клиничка фармакологија и Мере предострожности).
Код старијих пацијената елиминација Провигила и његових метаболита може бити смањена као последица старења. Стога треба размотрити употребу нижих доза код ове популације (Види Клиничка фармакологија и Мере предострожности).
врх
Како се испоручује
Провигил® (модафинил) Таблете
100 мг: Свака бела без премаза таблета у облику капсуле одлепљена је с „Провигил“ на једној страни и „100 МГ“ са друге.
НДЦ 63459-101-01 - Боце од 100
200 мг: Свака бела, бела, премазана таблета у облику капсуле одлепљена је с „Провигил“ на једној страни и „200 МГ“ на другој.
НДЦ 63459-201-01 - Боце од 100
Чувати на 20 ° - 25 ° Ц (68 ° - 77 ° Ф).
Произведено за:
Цепхалон, Инц.
Фразер, ПА 19355
Амерички патенти бр. РЕ37,516 / 4,927,855
© Цепхалон, Инц., 2008. Сва права задржана
ПРОВ-011
Ажурирано: 03/08
Информације о пацијенту Провигил (модафинил) (на обичном енглеском)
Детаљне информације о Знакови, симптоми, узроци, лечење поремећаја спавања
Информације у овој монографији нису намијењене покривању свих могућих употреба, упута, мјера опреза, интеракције лијекова или штетних учинака. Ове информације су уопштене и нису замишљене као посебни медицински савети. Ако имате питања о лековима које узимате или желите више информација, обратите се свом лекару, фармацеуту или медицинској сестри.
назад на:
~ сви чланци о поремећајима спавања



