Апидра за лечење дијабетеса
Робна марка: Апидра
Генеричко име: Инсулин Глулисине
Апидра (инсулин глулисине) је човеков производ који је готово идентичан људском инсулину. Користи се за лечење дијабетес мелитуса. Употреба, дозирање, нежељени ефекти.
Садржај:
Индикације и употреба
Дозирање и администрација
Контраиндикације
Упозорења и мере предострожности
Нежељене реакције
Интеракције са лековима
Употреба у одређеној популацији
Предозирање
Опис
Клиничка фармакологија
Неклиничка токсикологија
Клиничке студије
Како се испоручује
Апидра, инсулин глусин, информације о пацијенту (на обичном енглеском)
Индикације
Апидра је аналог људског инсулина брзог деловања који је индикован за побољшање контроле гликемије код одраслих и деце са шећерном болешћу.
врх
Дозирање и администрација
Питања дозирања
АПИДРА је рекомбинантни аналог инсулина који је изједначен са људским инсулином (тј. Једна јединица АПИДРА има исти ефекат за снижавање глукозе као једна јединица обичног хуманог инзулина) ако се даје интравенски. Када се даје супкутано, АПИДРА има бржи почетак деловања и краће време деловања од обичног хуманог инсулина.
Дозирање АПИДРА-е мора бити индивидуално. Праћење глукозе у крви је неопходно код свих пацијената који примају инсулинску терапију.
Укупна дневна потреба за инсулином може варирати и обично је између 0,5 до 1 Јединице / кг / дан. Потребе за инсулином могу се изменити током стреса, веће болести или са променама у вежбању, обрасцима оброка или лековима који се примењују истовремено.
Субкутана примена
АПИДРА се треба давати у року од 15 минута пре оброка или у року од 20 минута након почетка оброка.
АПИДРА дата субкутаном ињекцијом, генерално се треба користити у режимима са инзулином средњег или дуго делујућег инсулина.
АПИДРА се треба давати субкутаном ињекцијом у трбушни зид, бедро или надлактицу. Места убризгавања треба да се ротирају у истој регији (абдомен, бедро или надлактица) од једне до друге ињекције да би се смањио ризик од липодистрофије [Погледајте НЕЖЕЉЕНЕ РЕАКЦИЈЕ].
Континуирана поткожна инфузија (инсулинска пумпа)
АПИДРА се може давати континуираном поткожном инфузијом у трбушном зиду. Не користите разблажене или мешане инсулине у спољним инсулинским пумпама. Место инфузије треба ротирати унутар исте регије да би се смањио ризик од липодистрофије [Види НЕЖЕЉЕНЕ РЕАКЦИЈЕ]. Почетно програмирање пумпе за спољну инфузију инсулина треба да се заснива на укупној дневној дози инсулина из претходног режима.
Следеће инсулинске пумпе коришћене су у АПИДРА клиничким испитивањима која је спровео санофи-авентис, произвођач АПИДРА-е:
- Дисетрониц® Х-Трон® плус В100 и Д-Трон® са Дисетрониц катетерима (Рапид ™, Рапид Ц ™, Рапид Д ™ и Тендер ™)
- МиниМед® модели 506, 507, 507ц и 508 са МиниМед катетерима (Соф-сет Ултимате КР ™ и Куицк-сет ™).
Пре употребе друге инсулинске пумпе са АПИДРА-ом, прочитајте налепницу пумпе да бисте били сигурни да је пумпа оцењена са АПИДРА-ом.
Лекари и пацијенти требају пажљиво проценити информације о употреби црпки у АПИДРА прописаним информацијама, упутству за пацијента и упутству за употребу пумпе. Информације које су специфичне за АПИДРА-у требало би поштовати током употребе, учесталости мењања инфузијских сета или друго детаљи специфични за употребу АПИДРА-е, јер се АПИДРА-специфичне информације могу разликовати од општих упутстава за пумпу упутства.
На основу ин витро студија које су показале губитак деградације конзерванса, метакрезола и инсулина, АПИДРА у резервоару треба мењати најмање сваких 48 сати. АПИДРА у клиничкој употреби не сме бити изложена температурама већим од (37 ° Ц) већим од 98,6 ° Ф. [Види УПОЗОРЕЊА И УПОЗОРЕЊЕ и КАКО ДОСТАВА / Складиштење и руковање].
Интравенозна примена
АПИДРА се може давати интравенски под медицинским надзором за контролу гликемије уз пажљиво праћење глукозе у крви и калијума у серуму како би се избегле хипогликемије и хипокалемије. За интравенску употребу, АПИДРА треба да се користи у концентрацијама од 0,05 јединица / мл до 1 јединице / мл инсулина глулисин у инфузијским системима, користећи врећице од поливинил хлорида (ПВЦ). Показало се да је АПИДРА стабилна само у нормалном физиолошком раствору (0,9% натријум хлорида). Парентералне лекове требало би визуелно прегледати на основу честица и промене боје пре примене, кад год раствор и контејнери дозвољавају. Немојте давати смеше инсулина интравенски.
Облици и снаге дозирања
Апидра 100 јединица по мЛ (У-100) је доступна као:
- Бочице од 10 мл
- Уложак од 3 мл за употребу у ОптиЦлик-у® Уређај за доставу инсулина
- 3 мЛ СолоСтар напуњена оловка
врх
Контраиндикације
Апидра је контраиндицирана:
- током епизода хипогликемије
- код пацијената који су преосјетљиви на Апидру или на било који од његових помоћних састојака
Када се користи код пацијената са познатом преосјетљивошћу на Апидру или на његове помоћне састојке, пацијенти могу развити локализоване или генерализоване реакције преосјетљивости [Види Нежељене реакције].
врх
Упозорења и мере предострожности
Подешавање дозе и надгледање
Праћење глукозе је неопходно за пацијенте који примају инсулинску терапију. Промене режима инсулина треба уносити опрезно и само под лекарским надзором. Промјене у јакости инзулина, произвођачу, врсти или начину давања могу резултирати потребом за промјеном дозе инзулина. Можда ће требати прилагодити и истовремено орално антидијабетичко лечење.
Као и код свих инзулинских препарата, временски ток деловања за Апидра може варирати код различитих појединаца или у различито време иста особа и зависи од многих стања, укључујући место убризгавања, локално снабдевање крвљу или локално температура. Пацијентима који промене ниво физичке активности или плана оброка може бити потребно прилагођавање дозе инсулина.
Хипогликемија
Хипогликемија је најчешћа нежељена реакција инсулинске терапије, укључујући Апидру. Ризик од хипогликемије повећава се пооштреном контролом гликемије. Пацијенти се морају едуковати да препознају и управљају хипогликемијом. Тешка хипогликемија може довести до несвијести и / или конвулзија и може резултирати привременим или трајним оштећењем функције мозга или смрћу. Тешка хипогликемија која захтева помоћ друге особе и / или парентерална инфузија глукозе или примећена је примена глукагона у клиничким испитивањима инсулина, укључујући испитивања са Апидра.
Време хипогликемије обично одражава профил временског деловања администрираних формулација инсулина. Остали фактори као што су промене уноса хране (нпр. Количина хране или времена оброка), место убризгавања, вежбање и пратећи лекови такође могу променити ризик од хипогликемије [Погледајте Интеракције са лековима].
Као и код свих инсулина, будите опрезни код пацијената са несвесношћу хипогликемије и код пацијената који то могу бити предиспонирани за хипогликемију (нпр. педијатријска популација и пацијенти који постишу или имају погрешну храну усисни). Пацијентова способност концентрације и реакције може бити ослабљена као резултат хипогликемије. Ово може представљати ризик у ситуацијама у којима су ове способности посебно важне, као што су вожња или руковање другом машином.
Брзе промене нивоа глукозе у серуму могу изазвати симптоме сличне хипогликемији код особа са дијабетесом, без обзира на вредност глукозе. Симптоми раног упозоравања хипогликемије могу бити различити или мање изражени под одређеним условима, као што су дугогодишњи дијабетес, дијабетичка нервна болест, употреба лекова као што су бета блокатори [Види Интеракције са лековима], или појачана контрола дијабетеса. Ове ситуације могу резултирати озбиљном хипогликемијом (и, могуће, губитком свести) пре него што пацијент постане свестан хипогликемије.
Интравенски примењени инзулин има бржи почетак деловања од супкутано инзулина, па је потребно пажљивије праћење хипогликемије.
Преосјетљивост и алергијске реакције
Тешке, по живот опасне, генерализоване алергије, укључујући анафилаксију, могу се јавити са инсулинским производима, укључујући Апидру [Погледајте Нежељене реакције].
Хипокалемиа
Сви производи инсулина, укључујући Апидру, изазивају прелазак калијума из ванћелијског у унутарћелијски простор, што вероватно доводи до хипокалемије. Нелечена хипокалемија може изазвати респираторну парализу, вентрикуларну аритмију и смрт. Будите опрезни код пацијената који могу бити изложени ризику од хипокалемије (нпр. Пацијената који користе лекове који смањују калијум, пацијената који узимају лекове осетљиве на концентрацију калијума у серуму). Често пратите глукозу и калијум када се Апидра даје интравенски.
Оштећење бубрега или јетре
Често праћење глукозе и смањење дозе инсулина могу бити потребни пацијентима са оштећењем бубрега или јетре [Види Клиничка фармакологија].
Мешање инсулина
Апидра за поткожно убризгавање не сме се мешати са препаратима инсулина који нису НПХ инсулин. Ако се Апидра помеша са НПХ инсулином, прво га треба увући у шприц. Ињектирање треба да се деси одмах након мешања.
Не мешајте Апидра са другим инсулинама за интравенску примену или за употребу у континуираној поткожној инфузијској пумпи.
Апидра за интравенску примену не сме се разблажити растворима који нису 0,9% натријум хлорида (нормални физиолошки раствор). Није утврђена ефикасност и безбедност мешања Апидре са разблаживачима или другим инсулинама за употребу у спољним поткожним инфузијским пумпама.
Инфузијске пумпе за поткожне инсулине
Када се користи у спољној инсулинској пумпи за поткожну инфузију, Апидра се не сме разређивати или мешати са било којим другим инсулином. Апидру у резервоару треба мењати најмање сваких 48 сати. Апидра не сме бити изложена температурама већим од 37 ° Ц.
Неисправност инсулинске пумпе или инфузијског сета или разградња инсулина могу брзо довести до хипергликемије и кетозе. Неопходна је брза идентификација и корекција узрока хипергликемије или кетозе. Можда ће бити потребне привремене субкутане ињекције Апидром. Пацијенти који користе континуирану терапију поткожне инфузије инфузијом морају бити обучени за примену инсулина ињекцијом и на располагању је алтернативна терапија инсулином у случају квара пумпе. [Види Дозирање и администрација, Како се испоручује / складиштење и руковање].
Интравенозна примена
Када се Апидра даје интравенски, ниво глукозе и калијума мора се пажљиво надгледати како би се избегле потенцијално фаталне хипогликемије и хипокалемије.
Не мешајте Апидра са другим инсулинама за интравенску примену. Апидра се може разблажити само у уобичајеном физиолошком раствору.
Интеракције лијекова
Неки лекови могу да измене потребе за инсулином и ризик за хипогликемију или хипергликемију [Види Интеракције са лековима].
врх
Нежељене реакције
Следеће нежељене реакције су дискутоване на другом месту:
- Хипогликемија [Види Упозорења и мере предострожности]
- Хипокалемија [Види Упозорења и мере предострожности]
Клиничко искуство испитивања
Будући да се клиничка испитивања спроводе у оквиру различитих дизајна, стопа нежељених реакција пријављена у једном клиничком испитивању можда неће лако се упоређује са стопама пријављеним у другом клиничком испитивању и не мора одражавати стопе које су заиста примећене у клиничком испитивању вежба.
Учесталост нуспојава током клиничких испитивања Апидре код пацијената са шећерном болешћу типа 1 и шећерном болешћу типа 2 наведене су у доњим табелама.
Табела 1: Нежељени догађаји лечења у групним студијама одраслих са дијабетесом типа 1 (нежељени догађаји са учесталошћу ‰ ¥ 5%)
| АПИДРА,% (н = 950) |
Сви упоређивачиа, % (н = 641) |
|
| Насофарингитис | 10.6 | 12.9 |
| Хипогликемијаб | 6.8 | 6.7 |
| Инфекције горњих дисајних путева | 6.6 | 5.6 |
| Грипа | 4.0 | 5.0 |
|
а Инсулин лиспро, обични хумани инсулин, инзулин аспарт б Само јака симптоматска хипогликемија |
Табела 2: Нежељени догађаји лечења у групним студијама одраслих са дијабетесом типа 2 (нежељени догађаји са учесталошћу ‰ ¥ 5%)
| АПИДРА,% (н = 883) |
Редовни хумани инсулин,% (н = 883) |
|
| Инфекције горњих дисајних путева | 10.5 | 7.7 |
| Насофарингитис | 7.6 | 8.2 |
| Едемски периферни | 7.5 | 7.8 |
| Грипа | 6.2 | 4.2 |
| Артралгија | 5.9 | 6.3 |
| Хипертензија | 3.9 | 5. |
- Педијатрија
Табела 3 резимира нежељене реакције које су се појавиле са учесталошћу већом од 5% у клиничкој студији код деце и адолесцената са дијабетесом типа 1 лечених АПИДРА-ом (н = 277) или инсулином лиспро (н = 295).
Табела 3: Лечење - нежељени нежељени догађаји код деце и адолесцената са дијабетесом типа 1 (нежељене реакције са учесталошћу ‰ ¥ 5%)
| АПИДРА,% (н = 277) |
Лиспро,% (н = 295) |
|
| Насофарингитис | 9.0 | 9.5 |
| Инфекције горњих дисајних путева | 8.3 | 10.8 |
| Главобоља | 6.9 | 11.2 |
| Хипогликемијски напад | 6.1 | 4.7 |
- Тешка симптоматска хипогликемија
Хипогликемија је најчешће опажена нежељена реакција код пацијената који користе инсулин, укључујући Апидру [Види Упозорења и мере предострожности]. Стопе и учесталост тешке симптоматске хипогликемије, дефинисане као хипогликемија која захтева интервенцију треће стране, биле су упоредиве за све режиме лечења (видети Табелу 4). У клиничкој студији фазе 3, деца и адолесценти са дијабетесом типа 1 имали су већу учесталост од тешке симптоматске хипогликемије у две групе лечења у поређењу са одраслима са типом 1 дијабетес. (види Табелу 4) [Види Клиничке студије].
Табела 4: Тешка симптоматска хипогликемија *
| Дијабетес типа 1 Одрасли 12 недеља са инсулином гларгином |
Дијабетесни типови типа 1 26 недеља са инсулином гларгином |
Дијабетес типа 2 Одрасли 26 недеља са НПХ људским инсулином |
Дијабетес типа 1 26 недеља |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Апидра Пре оброка |
Апидра Пост-оброк |
Редовни хумани инзулин | Апидра | Инсулин Лиспро | Апидра | Редовни хумани инзулин | Апидра | Инсулин Лиспр | |
| * Тешка симптоматска хипогликемија дефинисана као хипогликемијски догађај за који је потребна помоћ друге особе која испуњава један од следећих критеријума: догађај је био повезан са крвном глукозом у крви пуном крви <36 мг / дл или је догађај био повезан са брзим опоравком након оралне примене угљених хидрата, интравенске глукозе или глукагона. | |||||||||
| Догађаји месечно по пацијенту | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Проценат пацијената (н / укупно Н) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Иницирање инзулина и интензивирање контроле глукозе
Интензивирање или брзо побољшање контроле глукозе повезано је са пролазним, реверзибилним поремећај офталмолошке рефракције, погоршање дијабетичке ретинопатије и акутна болна периферна болест неуропатија. Међутим, дуготрајна контрола гликемије смањује ризик од дијабетичке ретинопатије и неуропатије.
- Липодистрофија
Дуготрајна употреба инсулина, укључујући Апидру, може изазвати липодистрофију на месту поновљених ињекција или инфузије инсулина. Липодистрофија укључује липохипертрофију (задебљање масног ткива) и липоатрофију (прорјеђивање масног ткива), и може утицати на апсорпцију инсулина. Ротирајте места убризгавања или инфузије инсулина унутар исте регије да бисте смањили ризик од липодистрофије. [Види Дозирање и администрација].
- Добијање на тежини
До повећања телесне тежине може доћи код терапије инсулином, укључујући Апидру, и приписати се анаболичким ефектима инсулина и смањењу глукозурије.
- Периферни едем
Инсулин, укључујући Апидру, може да изазове задржавање натријума и едеме, посебно ако је претходно побољшана метаболичка контрола побољшана интензивираном инсулинском терапијом.
- Нежељене реакције континуираном субкутаном инфузијом инсулина (ЦСИИ)
У рандомизованој студији од 12 недеља код пацијената са дијабетесом типа 1 (н = 59), стопа катетера оклузије и реакције на месту инфузије биле су сличне код пацијената који су лечили Апидру и инзулин аспарт (Табела 5).
Табела 5: Оклузије катетера и реакције на месту инфузије.
| Апидра (н = 29) |
инсулин аспарт (н = 30) |
|
|---|---|---|
| Оклузија катетера / месец | 0.08 | 0.15 |
| Реакције на месту инфузије | 10.3% (3/29) | 13.3% (4/30) |
- Алергијске реакције
Локална алергија
Као и код било које терапије инсулином, и пацијенти који узимају Апидру могу на месту убризгавања осјетити црвенило, отицање или свраб. Ове мање реакције обично излазе за неколико дана до неколико недеља, али у неким случајевима могу бити потребни прекид примене Апидре. У неким случајевима ове реакције могу бити повезане са другим факторима осим инсулина, као што су иританти у средству за чишћење коже или лоша техника убризгавања.
Системска алергија
Тешка, по живот опасна, генерализована алергија, укључујући анафилаксију, може се појавити са било којим инсулином, укључујући Апидру. Генерализована алергија на инсулин може да изазове осип по целом телу (укључујући пруритус), диспнеју, пискање, хипотензију, тахикардију или дијафорезу.
У контролисаним клиничким испитивањима у трајању до 12 месеци, пријављене су потенцијалне системске алергијске реакције у 79 од 1833 пацијента (4,3%) који су примили Апидру и 58 од 1524 пацијента (3,8%) који су примили компаратер кратког деловања инсулини. Током ових испитивања, лечење Апидром је трајно обустављено код 1 од 1833 пацијента због потенцијалне системске алергијске реакције.
Извештавају се о локализованим реакцијама и генерализованим миалгијама уз употребу метакресола, који је помоћни састојак Апидре.
Производња антитела
У студији код пацијената са дијабетесом типа 1 (н = 333), концентрације инсулинских антитела које реагују и са људским инсулином и са инсулином глулисин (унакрсна реактивна антитела инсулина) остала је близу почетне вредности током првих 6 месеци студије код пацијената лечених Апидра. Током следећих 6 месеци испитивања примећено је смањење концентрације антитела. У студији код пацијената са дијабетесом типа 2 (н = 411), сличан пораст концентрације унакрсног реактивног антитела у инсулину био је сличан примећен код пацијената лечених Апидром и код пацијената лечених људским инсулином током првих 9 месеци студија. Након тога концентрација антитела се смањила код пацијената са Апидром и остала је стабилна код пацијената са хуманим инсулином. Није било корелације између унакрсне реактивне концентрације антитела инзулина и промена ХбА1ц, доза инсулина или учесталости хипогликемије. Клинички значај ових антитела није познат.
Апидра није изазвала значајан одговор на антитела у испитивању деце и адолесцената са дијабетесом типа 1.
Искуство након продаје
Следеће нежељене реакције идентификоване су током употребе Апидре након одобравања.
Како се ове реакције добровољно пријављују из популације неизвесне величине, то није увек је могуће поуздано проценити њихову учесталост или успоставити узрочно-последичну везу са леком излагање.
Забележене су грешке у лековима у којима су уместо Апидре случајно давани други инсулини, нарочито дуго делујући инсулини.
врх
Интеракције са лековима
Бројни лекови утичу на метаболизам глукозе и могу захтевати прилагођавање дозе инсулина и нарочито пажљиво праћење.
Лијекови који могу појачати учинак снижавања глукозе у крви, укључујући Апидру, и самим тим повећавају ризик од хипогликемије, укључују оралне антидијабетичке производе, прамлинтид, АЦЕ инхибитори, дисопирамид, фибрати, флуоксетин, инхибитори моноамин оксидазе, пропоксифен, пентоксифилин, салицилати, соматостатин аналози и сулфонамид антибиотици
Лекови који могу смањити ефекат Апидре на снижавање глукозе у крви укључују кортикостероиде, ниацин, даназол, диуретике, симпатомиметичке агенсе (нпр. Епинефрин, албутерол, тербуталин), глукагон, изониазид, фенотиазински деривати, соматропин, хормони штитне жлезде, естрогени, прогестогени (нпр., у оралним контрацептивима), инхибитори протеазе и атипични антипсихотици.
Бета блокатори, клонидин, литијумске соли и алкохол могу или повећати или умањити учинак инсулина на снижавање глукозе у крви.
Пентамидин може изазвати хипогликемију, која понекад може бити праћена хипергликемијом.
Знаци хипогликемије могу бити смањени или одсутни код пацијената који узимају анти-адренергичке лекове, попут бета блокатора, клонидина, гванетидина и резерпина.
врх
Употреба у одређеној популацији
Трудноћа
Категорија трудноће Ц: Истраживања о репродукцији и тератологији спроведена су са глулисином инсулина код пацова и кунића који су користили обични хумани инсулин као компаратор. Инсулински глулисин даје се женкама пацова током трудноће у поткожним дозама до 10 јединица / кг једном дневно (доза резултира у изложеност 2 пута већа од просечне дозе за човека, на основу поређења површине тела) и није имала изузетне токсичне ефекте на ембрио-фетус развој.
Инсулински глулисин даје се женкама зечевима током трудноће у поткожним дозама до 1,5 Јединице / кг / дан (доза резултира излагањем 0,5 пута већом од просечне дозе за људе, на основу површине тела поређење). Нежељени ефекти на ембрионално-фетални развој примећени су само код нивоа дозе токсичних за мајку који индукује хипогликемију. Забележена је повећана учесталост губитака после имплантације и коштаних оштећења код нивоа дозе од 1,5 Јединице / кг једном дневно (доза што доводи до изложености 0,5 пута веће од просечне дозе за човека, на основу поређења површине тела), што је такође изазвало смртност у бране Незнатна повећана учесталост губитака након имплантације примећена је код следеће ниже дозе од 0,5 Јединица / кг једном дневно (доза резултира изложеношћу 0,2 пута већа од просечне дозе за човека, на основу поређења површине тела), која је такође била повезана са тешком хипогликемијом, али при томе није било оштећења доза. Нису примећени ефекти код кунића у дози од 0,25 јединица / кг једном дневно (доза резултира излагањем 0,1 пута већом од просечне дозе за човека, на основу поређења површине тела). Ефекти инсулина глулисина нису се разликовали од оних примећених поткожним регуларним људским инсулином у истим дозама и приписани су секундарним ефектима мајчинске хипогликемије.
Нема добро контролисаних клиничких студија о примени Апидре у трудница. Пошто студије репродукције животиња не предиктивно одговарају људском одговору, овај лек треба користити током трудноће само ако потенцијална корист оправдава потенцијални ризик за плод. За пацијенте са дијабетесом или историјом гестацијског дијабетеса од суштинског је значаја да одржавају добру метаболичку контролу пре зачећа и током трудноће. Потребе за инсулином могу се смањити током првог тромесечја, углавном се повећавају током другог и трећег тромесечја и брзо опадају након порођаја. Пажљиво праћење контроле глукозе је неопходно код ових пацијената.
Неговане мајке
Није познато да ли се инсулински глулисин излучује у мајчином млеку. Пошто се многи лекови излучују у људском млеку, требало би бити опрезан када се Апидра даје негованој жени. Употреба Апидре компатибилна је с дојењем, али женама са дијабетесом које доје могу бити потребне прилагодбе дозе инсулина.
Педијатријска употреба
Сигурност и ефикасност поткожних ињекција Апидре утврђене су код педијатријских болесника (узраста од 4 до 17 година) са дијабетесом типа 1 [Погледајте Клиничке студије]. Апидра није проучаван у педијатријских болесника са дијабетесом типа 1 млађих од 4 године и код педијатријских болесника са дијабетесом типа 2.
Као и код одраслих, доза Апидре се мора индивидуализовати код педијатријских пацијената на основу метаболичких потреба и учесталог праћења глукозе у крви.
Геријатријска употреба
У клиничким испитивањима (н = 2408) Апидра је примењен 147 пацијената старијих од 65 година и 27 пацијената старијих од 75 година. Већина овог малог подскупа старијих пацијената имала је дијабетес типа 2. Промена вредности ХбА1ц и фреквенција хипогликемије нису се разликовале по годинама. Ипак, с опрезом треба бити опрезан када се Апидра примењује на геријатријским пацијентима.
врх
Предозирање
Вишак инсулина може изазвати хипогликемију и, нарочито ако се даје интравенски, хипокалемију. Благе епизоде хипогликемије обично се могу лечити оралном глукозом. Можда ће бити потребно прилагођавање дозирања лекова, образаца оброка или вежбања. Теже епизоде хипогликемије са комом, нападајем или неуролошким оштећењем могу се лечити интрамускуларним / поткожним глукагоном или концентрованом интравенском глукозом. Трајни унос угљених хидрата и проматрање могу бити потребни јер се хипогликемија може поновити након очигледног клиничког опоравка. Хипокалемија се мора на одговарајући начин исправити.
Опис
Апидра® (убризгавање инсулина глулисин [рДНА поријекло]) је брзи аналог људског инсулина који се користи за снижавање глукозе у крви. Инсулински глулисин производи се рекомбинантном ДНК технологијом користећи непатогени лабораторијски сој Есцхерицхиа цоли (К12). Инсулински глулисин разликује се од хуманог инзулина по томе што је аминокиселина аспарагин у положају Б3 замењена лизином, а лизин у положају Б29 замењен глутаминском киселином. Хемијски, инсулин глулисин је 3Б-лизин-29Б-глутаминска киселина-хумани инзулин, има емпиријску формулу Ц258Х384Н64О78С6 и молекулску масу 5823 и има следећу структурну формулу:
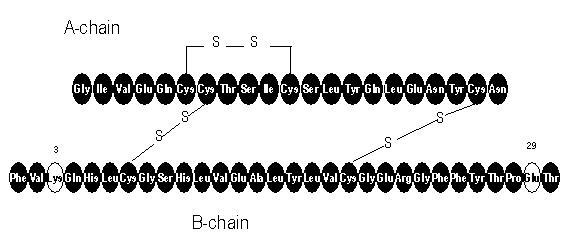
Апидра је стерилни, водени, бистри и безбојни раствор. Сваки милилитер Апидре садржи 100 јединица (3,49 мг) инсулина глулисин, 3,15 мг метакрезола, 6 мг трометамина, 5 мг натријум-хлорида, 0,01 мг полисорбата 20 и воде за ињекције. Апидра има пХ од приближно 7,3. ПХ се подешава додавањем водених раствора хлороводоничне киселине и / или натријум хидроксида.
врх
Клиничка фармакологија
Механизам дејства
Регулација метаболизма глукозе је примарна активност инсулина и аналога инсулина, укључујући инсулин глулисин. Инсулини снижавају глукозу у крви стимулишући периферни унос глукозе скелетним мишићима и масноћом и инхибирајући стварање јетрене глукозе. Инсулини инхибирају липолизу и протеолизу и појачавају синтезу протеина.
Активности снижавања глукозе Апидре и обичног хуманог инсулина су изједначене када се примењују интравенским путем. После супкутане примене, ефекат Апидре је бржи у почетку и краћем трајању у поређењу са обичним хуманим инсулином. [Погледајте Фармакодинамика].
Фармакодинамика
Студије на здравим добровољцима и пацијентима са дијабетесом показале су да Апидра има бржи ефекат почетак деловања и краће трајање активности од уобичајеног хуманог инсулина када се даје поткожно.
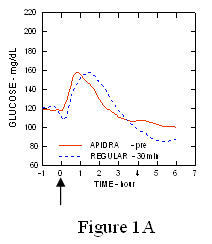
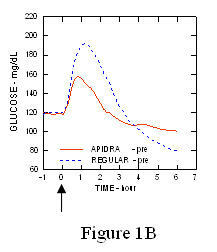
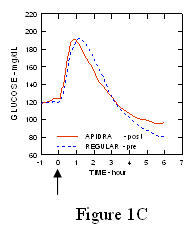
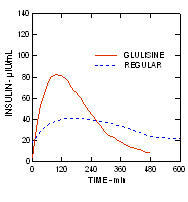
У студији код пацијената са дијабетесом типа 1 (н = 20), профили Апидре и снижавају глукозу регуларни хумани инсулин су процењени у различитим временима у односу на стандардни оброк у дози од 0,15 Јединице / кг (Слика 1.)
Максимална екскурзија глукозе у крви (И ”ГЛУмак; базна одузета концентрација глукозе) за Апидра убризган 2 минуте пре оброка био је 65 мг / дЛ у поређењу са 64 мг / дЛ за обичне људе ињицирани инзулин 30 минута пре оброка (види слику 1А), и 84 мг / дЛ за обични хумани инсулин убризган 2 минута пре оброка (видети слику 1Б). Максимална екскурзија глукозе у крви за Апидру убризгана 15 минута након почетка оброка била је 85 мг / дЛ у поређењу са 84 мг / дЛ за обични хумани инсулин убризган 2 минута пре оброка (видети слику 1Ц).
Слика 1. Серијска средња глукоза у крви сакупљена до 6 сати након једне дозе Апидре и обичног хуманог инсулина. Апидра је добила 2 минута (Апидра - пре) пре почетка оброка у поређењу са обичним људским инсулином који је добијао 30 минута (редован - 30 мин) пре почетка оброка (слика 1А) и упоређено са уобичајеним људским инсулином (редовно - пре) које се даје 2 минута пре оброка (слика 1Б). Апидра је добила 15 минута (Апидра - пост) након почетка оброка у поређењу са обичним хуманим инсулином (обичним - пре) који се даје 2 минута пре оброка (слика 1Ц). На н оси к (0) је почетак оброка од 15 минута.
 |
 |
 |
 |
У рандомизованом, двосмерном унакрсном истраживању са отвореним натписом, 16 здравих мушких испитаника примљено је интравенски инфузија Апидре или обичног хуманог инсулина са физиолошким растварачем брзином од 0,8 милиУнита / кг / мин за две сати. Инфузија исте дозе Апидре или обичног хуманог инсулина даје еквивалентно одлагање глукозе у стабилном стању.
Фармакокинетика
Апсорпција и биорасположивост
Фармакокинетички профили код здравих добровољаца и пацијената са шећерном болешћу (тип 1 или тип 2) показали су да је апсорпција глулисина инсулина бржа него код обичног хуманог инзулина.
У студији код пацијената са дијабетесом типа 1 (н = 20) након субкутане примене 0,15 јединица / кг, средњи пут до максималне концентрације (Тмак) била је 60 минута (распон 40 до 120 минута) и максимална концентрација (Цмак) је била 83 микроУнита / мЛ (распон 40 до 131 микроУнита / мЛ) за инсулин глулисин у поређењу са средњим Тмак-ом од 120 минута (распон 60 до 239 минута) и Цмак од 50 микроУнита / мЛ (распон 35 до 71 микроУнита / мЛ) за обичног човека инсулин. (Слика 2)
Слика 2. Фармакокинетички профили инсулина глулисина и обичног хуманог инсулина код пацијената са дијабетесом типа 1 након дозе од 0,15 Јединица / кг.

Инсулински глулисин и обични хумани инсулин примењени су супкутано, у дози од 0,2 јединице / кг у ану Еуглицемиц цламп студија код пацијената са дијабетесом типа 2 (н = 24) и индекс телесне масе (БМИ) између 20 и 36 кг / м2. Медијан времена до максималне концентрације (Тмак) био је 100 минута (распон 40 до 120 минута), а средња вршна концентрација (Цмак) била је 84 микроУнита / мЛ (распон 53 до 165 микроУнита / мЛ) за глулисин инсулина у поређењу са средњим Тмак-ом од 240 минута (распон 80 до 360 минута) и средњим Цмак од 41 микроУнитс / мЛ (распон 33 до 61 микроУнита / мЛ) за обични хумани инсулин. (Слика 3.)
Слика 3. Фармакокинетички профили инсулина глулисина и обичног хуманог инсулина код пацијената са дијабетесом типа 2 након поткожне дозе од 0,2 Јединице / кг.
Када се Апидра убризгава супкутано у различита подручја тела, профили временске концентрације били су слични. Апсолутна биорасположивост инсулина глулисина после супкутане примене износи око 70%, без обзира на подручје убризгавања (трбух 73%, делтоид 71%, бутина 68%).
У клиничкој студији на здравим добровољцима (н = 32), укупна биорасположивост инсулина глулисина била је слична након поткожне убризгавање инсулина глулисин и НПХ инсулина (смешаног у шприцу) и следеће одвојене истовремено супкутане ињекције Било је 27% слабљење максималне концентрације (Цмак) Апидре након прексидације; међутим, време на максималну концентрацију (Тмак) није утицало. Нема података о мешању Апидре са инзулинским препаратима који нису НПХ инсулин. [Види Клиничке студије].
Дистрибуција и елиминација
Дистрибуција и елиминација инсулина глулисин и обичног хуманог инсулина након интравенске примјена је слична количинама дистрибуције од 13 и 21 Л и полуживотом од 13 и 17 минута, редом. После супкутане примене, инсулин глулисин се елиминише брже од уобичајеног хуманог инзулина, привидни полуживот од 42 минута у поређењу са 86 минута.
Клиничка фармакологија код специфичне популације
Педијатријски пацијенти
Фармакокинетичка и фармакодинамичка својства Апидре и обичног хуманог инсулина процењена су у а студија спроведена код деце од 7 до 11 година (н = 10) и адолесцената од 12 до 16 година (н = 10) са типом 1 дијабетес. Релативне разлике у фармакокинетикама и фармакодинамикама између Апидре и обичног хуманог инсулина у ови болесници са дијабетесом типа 1 били су слични онима код здравих одраслих испитаника и одраслих са типом 1 дијабетес.
Трка
Испитивање 24 здравих бијелаца и јапанаца упоредило је фармакокинетику и фармакодинамику након поткожне ињекције инсулина глулисина, инсулина лиспро и обичног хуманог инзулина. Са супкутаном ињекцијом инсулина глулисина, јапански испитаници су имали већу почетну изложеност (33%) за однос АУЦ (0-1х) према АУЦ (крај 0-стеге) у односу на белце (21%), иако су укупне изложености биле слично. Постојали су слични налази са инсулином лиспро и обичним људским инсулином.
Гојазност
Инсулински глулисин и обични хумани инсулин примењени су супкутано, у дози од 0,3 Јединице / кг у а студија еугликемијске стезања код гојазних, не-дијабетичара (н = 18) са индексом телесне масе (БМИ) између 30 и 40 кг / м2. Медијан времена до максималне концентрације (Тмак) био је 85 минута (распон 49 до 150 минута), а средња вршна концентрација (Цмак) била је 192 микроУнита / мЛ (распон 98 до 380 микроУнита / мЛ) за глулисин инсулина у поређењу са средњим Тмак-ом од 150 минута (распон од 90 до 240 минута) и средњим Цмак од 86 микроУнита / мЛ (распон 43 до 175 микроУнита / мЛ) за обичног човека инсулин.
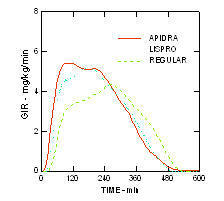
Бржи почетак деловања и краће трајање активности Апидре и инсулина лиспро у поређењу са обичним људским инсулином одржавани су у претилој популацији без дијабетеса (н = 18). (Слика 4.)
Слика 4. Брзина инфузије глукозе (ГИР) у студији еугликемијске стезаљке након поткожне ињекције 0,3 јединица / кг Апидре, инсулина лиспро или обичног хуманог инзулина код гојазне популације.
Оштећење бубрега
Студије са људским инсулином показале су повећани ниво циркулације инзулина код пацијената са затајивањем бубрега. У студији спроведеној на 24 субјекта који нису дијабетични, са нормалном функцијом бубрега (ЦлЦр> 80 мл / мин), умереним оштећењем бубрега (30-50 мл / мин) и тешким оштећењем бубрега (Упозорења и мере предострожности).
Оштећење јетре
Учинак оштећења јетре на фармакокинетику и фармакодинамику Апидре није проучен. Неке студије са хуманим инсулином показале су повећани ниво циркулације инзулина код пацијената са затајењем јетре. [Види Упозорења и мере предострожности].
Пол
Учинак рода на фармакокинетику и фармакодинамику Апидре није проучен.
Трудноћа
Учинак трудноће на фармакокинетику и фармакодинамику Апидре није проучен.
Пушење
Учинак пушења на фармакокинетику и фармакодинамику Апидре није проучен.
врх
Неклиничка токсикологија
Канцерогенеза, мутагенеза, оштећење плодности
Стандардна двогодишња испитивања канцерогености на животињама нису извршена. Код пацова Спрагуе Давлеи спроведено је 12-месечно испитивање токсичности за поновљене дозе са инсулином глулисин у поткожним дозама од 2,5, 5, 20 или 50 јединица / кг два пута дневно (доза резултира излагањем 1, 2, 8 и 20 пута више од просечне дозе за човека, на основу површине тела поређење).
Постојала је већа учесталост тумора млечне жлезде код женки пацова који су примењивали инсулин глулисин у поређењу са не леченим контролама. Учесталост тумора дојке за инсулин глулисин и обични хумани инсулин била је слична. Значај ових налаза за људе није познат. Инсулински глулисин није мутаген у следећим тестовима: Амесов тест, ин витро хромосом сисара тест аберације у В79 ћелијама кинеског хрчка и ин виво микронуклеусни тест еритроцита сисара у пацови.
У студијама плодности код мушких и женских пацова у поткожним дозама до 10 јединица / кг једном дневно (доза резултира излагањем 2 пута већим од просечног човека доза, заснована на упоређивању површине тела), није било јасних штетних ефеката на плодност мушкараца и жена, нити на опште репродуктивне перформансе животиња посматрано.
врх
Клиничке студије
Сигурност и ефикасност Апидре проучавана је код одраслих пацијената са дијабетесом типа 1 и типа 2 (н = 1833) и код деце и адолесцената (4 до 17 година) са дијабетесом типа 1 (н = 572). Примарни параметар ефикасности у овим испитивањима био је гликемијска контрола, процењена коришћењем гликозованог хемоглобина (ГХб је пријављен као еквивалент ХбА1ц).
Дијабетес типа 1 за одрасле
Извршено је 26-недељно, рандомизовано, отворено испитивање, активно контролисано, не-инфериорност код пацијената са дијабетесом типа 1 да би се проценила сигурност и ефикасност Апидре (н = 339) у поређењу са инсулином лиспро (н = 333), када се даје супкутано у року од 15 минута пре оброк. Инсулин гларгин је примењиван једном дневно увече као базни инсулин. Постојао је период од 4 недеље са инсулином лиспро и инсулином гларгином пре рандомизације. Већина пацијената била је кавкашка (97%). Педесет осам посто пацијената били су мушкарци. Средња доб је била 39 година (распон од 18 до 74 године). Гликемијска контрола, број дневних ињекција инзулина кратког деловања и укупне дневне дозе Апидре и инсулина лиспро били су слични у две групе лечења (Табела 6).
Табела 6: Шећерна болест типа 1 - за одрасле
| Трајање лечења Лечење у комбинацији са: |
26 недеља Инсулин гларгин |
|
|---|---|---|
| Апидра | Инсулин Лиспро | |
| ||
| Гликовани хемоглобин (ГХб)* (%) | ||
| Број пацијената | 331 | 322 |
| Основна средња вредност | 7.6 | 7.6 |
| Прилагођена средња промена од почетне | -0.1 | -0.1 |
| Разлика у лечењу: Апидра - Инсулин Лиспро | 0.0 | |
| 95% ЦИ за разлику у лечењу | (-0.1; 0.1) | |
| Базална доза инсулина (јединица / дан) | ||
| Основна средња вредност | 24 | 24 |
| Прилагођена средња промена од почетне | 0 | 2 |
| Кратко делујућа доза инсулина (Јединице дневно) | ||
| Основна средња вредност | 30 | 31 |
| Прилагођена средња промена од почетне | -1 | -1 |
| Средњи број убризгавања инзулина кратког деловања дневно | 3 | 3 |
| Телесна тежина (кг) | ||
| Основна средња вредност | 73.9 | 74.1 |
| Средња промена од почетне | 0.6 | 0.3 |
Дијабетес типа 2 за одрасле
Извршено је 26-недељно, рандомизовано, отворено испитивање, активно контролисано, не-инфериорност код пацијената који су лечили инсулином са дијабетесом типа 2 да би се проценила сигурност и ефикасност Апидре (н = 435) који се даје у року од 15 минута пре оброка у поређењу са обичним људским инсулином (н = 441) који се даје 30 до 45 минута пре оброк. НПХ хумани инсулин дат је два пута дневно као базни инсулин. Сви пацијенти су учествовали у периоду од 4 недеље са редовним људским инсулином и НПХ хуманим инсулином. Осамдесет и пет посто пацијената било је белцима, а 11% црнаца. Средња старост је била 58 година (распон од 26 до 84 године). Просечни индекс телесне масе (БМИ) био је 34,6 кг / м2. Током рандомизације 58% пацијената узимало је орално антидијабетичко средство. Ови пацијенти су упућени да наставе да користе орално антидијабетичко средство у истој дози током целог испитивања. Већина пацијената (79%) је помешала свој кратко делујући инзулин са НПХ хуманим инсулином непосредно пре ињекције. Смањења почетне вредности у ГХб била су слична између две групе за лечење (видети Табелу 7). Нису уочене разлике између Апидра и обичних хуманих инзулинских група у броју дневних ињекција инзулина кратког деловања или базних или кратко делотворних доза инзулина. (Види табелу 7.)
Табела 7: дијабетес мелитус типа 2 за одрасле
| Трајање лечења | 26 недеља | |
|---|---|---|
| Лечење у комбинацији са: | НПХ хумани инсулин | |
| Апидра | Редовни хумани инзулин | |
| ||
| Гликовани хемоглобин (ГХб)* (%) | ||
| Број пацијената | 404 | 403 |
| Основна средња вредност | 7.6 | 7.5 |
| Прилагођена средња промена од почетне | -0.5 | -0.3 |
| Разлика у лечењу: Апидра - редовни хумани инзулин | -0.2 | |
| 95% ЦИ за разлику у лечењу | (-0.3; -0.1) | |
| Базална доза инсулина (јединица / дан) | ||
| Основна средња вредност | 59 | 57 |
| Прилагођена средња промена од почетне | 6 | 6 |
| Кратко делујућа доза инсулина (Јединице дневно) | ||
| Основна средња вредност | 32 | 31 |
| Прилагођена средња промена од почетне | 4 | 5 |
| Средњи број убризгавања инзулина кратког деловања дневно | 2 | 2 |
| Телесна тежина (кг) | ||
| Основна средња вредност | 100.5 | 99.2 |
| Средња промена од почетне | 1.8 | 2.0 |
Дијабетес типа 1: Одрасли: Прије и послије јела
Извршено је 12-недељно, рандомизовано, отворено испитивање, активно контролисано, не-инфериорност, код пацијената са дијабетес типа 1 за процену сигурности и ефикасности Апидре који се примењује у различито време у односу на а оброк. Апидра је примењена субкутано било 15 минута пре оброка (н = 286) или непосредно после уноса оброк (н = 296) и обични хумани инсулин (н = 278) примењени су супкутано 30 до 45 минута пре оброк. Инсулин гларгин је даван једном дневно пре спавања као базни инсулин. Постојао је период од 4 недеље са редовним људским инсулином и инсулином гларгин праћен рандомизацијом. Већина пацијената су била белци (94%). Средња доб је била 40 година (распон од 18 до 73 године). Гликемијска контрола (види Табелу 8) је била упоредива за 3 режима лечења. Нису уочене промјене од почетне вриједности између третмана у укупном дневном броју ињекција инзулина кратког дјеловања. (Види табелу 8.)
Табела 8: Примена пре и после јела код дијабетеса мелитуса типа 1 код одраслих
| Трајање лечења Лечење у комбинацији са: |
12 недеља инсулин гларгин |
12 недеља инсулин гларгин |
12 недеља инсулин гларгин |
|---|---|---|---|
| Апидра пре оброка |
Апидра пост оброк |
Редовни хумани инзулин | |
| |||
| Гликовани хемоглобин (ГХб)* (%) | |||
| Број пацијената | 268 | 276 | 257 |
| Основна средња вредност | 7.7 | 7.7 | 7.6 |
| Прилагођена средња промена од почетне†| -0.3 | -0.1 | -0.1 |
| Базална доза инсулина (јединица / дан) | |||
| Основна средња вредност | 29 | 29 | 28 |
| Прилагођена средња промена од почетне | 1 | 0 | 1 |
| Кратко делујућа доза инсулина (Јединице дневно) | |||
| Основна средња вредност | 29 | 29 | 27 |
| Прилагођена средња промена од почетне | -1 | -1 | 2 |
| Средњи број убризгавања инзулина кратког деловања дневно | 3 | 3 | 3 |
| Телесна тежина (кг) | |||
| Основна средња вредност | 79.2 | 80.3 | 78.9 |
| Средња промена од почетне | 0.3 | -0.3 | 0.3 |
Пацијенти са дијабетесом типа 1
Извршено је 26-недељно рандомизовано, отворено испитивање, активно контролисано, не-инфериорност код деце и адолесцената старијих од 4 године са типом 1 дијабетес мелитус за процену сигурности и ефикасности Апидре (н = 277) у поређењу са инсулином лиспро (н = 295), када се даје супкутано у року од 15 минута пре оброк. Пацијенти су такође примали инсулин гларгин (примењиван једном дневно увече) или НПХ инсулин (примењиван једном ујутру и једном увече). Постојао је период од 4 недеље са инсулином лиспро и инсулином гларгином или НПХ пре рандомизације. Већина пацијената била је кавкашка (91%). Педесет процената пацијената били су мушкарци. Средња доб је била 12,5 година (распон 4 до 17 година). Средњи БМИ је био 20,6 кг / м2. Гликемијска контрола (види Табелу 9) била је упоредива за два режима лечења.
Табела 9: Резултати 26-недељног испитивања на педијатријским пацијентима са шећерном болешћу типа 1
| Апидра | Лиспро | |
|---|---|---|
| Број пацијената | 271 | 291 |
| Базални инзулин | НПХ или инсулин гларгин | НПХ или инсулин гларгин |
| ||
| Гликовани хемоглобин (ГХб)* (%) | ||
| Основна средња вредност | 8.2 | 8.2 |
| Прилагођена средња промена од почетне | 0.1 | 0.2 |
| Разлика у третману: средња (95% интервал поузданости) | -0.1 (-0.2, 0.1) | |
| Базална доза инсулина (Јединице / кг / дан) | ||
| Основна средња вредност | 0.5 | 0.5 |
| Средња промена од почетне | 0.0 | 0.0 |
| Кратко делујућа доза инсулина (Јединице / кг / дан) | ||
| Основна средња вредност | 0.5 | 0.5 |
| Средња промена од почетне | 0.0 | 0.0 |
| Средњи број убризгавања инзулина кратког деловања дневно | 3 | 3 |
| Средња основна телесна тежина (кг) | 51.5 | 50.8 |
| Просечна промена тежине од почетне (кг) | 2.2 | 2.2 |
Дијабетес типа 1 у одраслих: Континуирана поткожна инфузија инсулина
12-недељно рандомизовано, активно контролно истраживање (Апидра наспрам инсулина аспарт) спроведено на одраслим особама са дијабетесом типа 1 (Апидра н = 29, инзулин аспарт н = 30) процењена је употреба Апидре у спољном континуираном поткожном инсулину пумпа. Сви пацијенти су били белци. Средња старост је била 46 година (распон од 21 до 73 године). Средња вредност ГХб порасла је од почетне до крајње тачке у обе групе за лечење (са 6,8% на 7,0% за Апидра; од 7,1% до 7,2% за инсулин аспарт).
врх
Како се испоручује / складиштење и руковање
Како се испоручује
| |
| Апидра 100 јединица по мЛ (У-100) је доступна као: | |
| Бочице од 10 мл | НДЦ 0088-2500-33 |
| Картуша од 3 мЛ*, пакет од 5 | НДЦ 0088-2500-52 |
| 3 мЛ СолоСтар напуњена оловка, паковање од 5 | НДЦ 0088-2502-05 |
Игле за оловке нису укључене у паковање.
Игле за оловке БД Ултра-Фине ™1 које се користе заједно са ОптиЦлик-ом продају се засебно, а производе их Бецтон Дицкинсон и Цомпани.
Солостар је компатибилан са свим иглама за оловке компаније Бецтон Дицкинсон анд Цомпани, Ипсомед и Овен Мумфорд.
Складиште
Не употребљавати после истека рока трајања (видети кутију и посуду).
Неотворени систем бочица / уложака / СолоСтар
Неотворене бочице Апидра, систем кертриџа и СолоСтар треба чувати у хладњаку (2 ° Ц-8 ° Ц), 36 ° Ф-46 ° Ф. Заштитите од светлости. Апидра се не сме чувати у замрзивачу и не сме се смрзнути. Одбаците је ако је била смрзнута.
Неотворене бочице / систем кертриџа / СолоСтар који се не чувају у хладњаку морају се користити у року од 28 дана.
Отворена бочица (током употребе):
Отворене бочице, без обзира да ли су у хладњаку или не, морају се користити у року од 28 дана. Ако хлађење није могуће, отворена бочица у употреби може се држати у хладњаку до 28 дана, од директне топлоте и светлости, све док температура није већа од 25 ° Ц.
Отворени (током употребе) систем кертриџа:
Отворени (током употребе) систем уложака уметнут у ОптиЦлик® НЕ треба хладити, већ га треба чувати испод (25 ° Ц) далеко од директне топлоте и светлости. Отворени (у употреби) систем уложака мора се одбацити након 28 дана. Никада не чувајте ОптиЦлик®, са или без кертриџа, у фрижидеру.
Отворите (употријебите) СолоСтар напуњену оловку:
Отворени (током употребе) СолоСтар НЕ треба хладити, већ га треба чувати испод (25 ° Ц) далеко од директне топлоте и светлости. Отворени (током употребе) СолоСтар чуван на собној температури мора се одбацити након 28 дана.
Инфузијски сетови:
Инфузијске сетове (резервоаре, цеви и катетере) и Апидру у резервоару треба одбацити након 48 сати употребе или након излагања температурама које пређу 98,6 ° Ф (37 ° Ц).
Интравенска употреба:
Инфузијске кесице припремљене како је наведено под ДОЗИРАЊЕ И АДМИНИСТРАЦИЈА су стабилне на собној температури током 48 сати.
Припрема и руковање
Након разблаживања за интравенску употребу, раствор треба визуелно прегледати на основу честица и боје боје пре примене. Не користите раствор ако је постао замућен или садржи честице; користите само ако је бистра и безбојна. Апидра није компатибилна са раствором Декстрозе и Рингерсовим раствором и, према томе, не може се користити са овим течностима раствора. Примена Апидре са другим растворима није проучена и због тога се не препоручује.
Систем кертриџа: Ако ОптиЦлик® (уређај за достављање инсулина за Апидру) не ради, Апидра се може извући из система кертриџа у У-100 шприцу и убризгати.
Апидра, инсулин глусин, информације о пацијенту (на обичном енглеском)
последње ажурирано: 02/2009
Детаљне информације о знаковима, симптомима, узроцима, лечењу дијабетеса
Информације у овој монографији нису намијењене покривању свих могућих употреба, упута, мјера опреза, интеракције лијекова или штетних учинака. Ове информације су уопштене и нису замишљене као посебни медицински савети. Ако имате питања о лековима које узимате или желите више информација, обратите се свом лекару, фармацеуту или медицинској сестри.
назад на: Прегледајте све лекове за дијабетес



