Екубера за лечење дијабетеса
Бренд: Екубера
Генеричко име: хумани инсулин
Облик дозирања: прашак за инхалацију
Садржај:
Опис
Клиничка фармакологија
Клиничке студије
Индикације и употреба
Контраиндикације
Упозорења
Мере предострожности
Интеракције са лековима
Нежељене реакције
Предозирање
Дозирање и администрација
Како се испоручује
Екубера, хумани инзулин [рДНА порекло] Информације о пацијенту (на обичном енглеском)
Опис
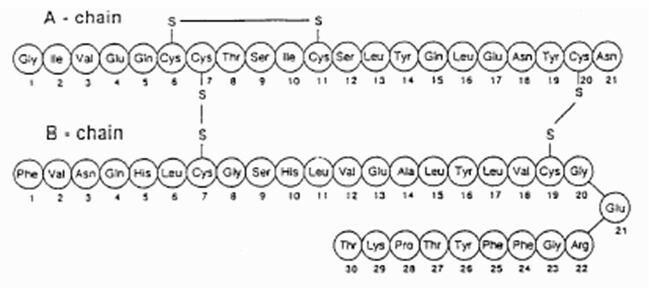
Екубера® састоји се од блистера који садрже прашак за инхалацију хуманог инсулина, који се даје применом Екубера® Инхалер. Блистери Екубера садрже хумани инсулин произведен рекомбинантном ДНК технологијом, користећи непатогени лабораторијски сој Есцхерицхиа цоли (К12). Хемијски, хумани инсулин има емпиријску формулу Ц257Х383Н65О77С6 и молекулска тежина 5808. Хумани инсулин има следећу секвенцу примарних аминокиселина:
Екубера (хумани инсулин [рДНА порекло]) Инхалациони прах је бели до сиво прах у блистеру са јединичном дозом (испуните масу, погледајте Табелу 1). Сваки јединични дозни блистер Екубере садржи дозу 1 мг или 3 мг инсулина (види Табелу 1) у а хомогена формулација прашка која садржи натријум цитрат (дихидрат), манитол, глицин и натријум хидроксид. Након што је блистер Екубера убачен у инхалатор, пацијент пумпа дршку инхалатора, а затим притисне дугме, изазивајући продирање блистера. Прах за инхалацију инсулина се затим распршује у комору, омогућавајући пацијенту да инхалира аеросолизовани прах.
Под стандардизованим ин витро условима испитивања, Екубера испоручује специфичну емитовану дозу инсулина из усника инхалатора (видети Табелу 1). Део укупне масе честица се емитује у облику ситних честица способних да дођу до дубоког плућа. У блистеру се може задржати до 45% од 1 мг садржаја блистера и до 25% од 3 мг садржаја блистера.
Табела 1: Номенклатура и информације о дозирању
| Испуните мису (мг праха) |
Номинална доза (мг инсулина) |
Емитована доза*,†(мг инсулина) |
Доза ситних честицац,†(мг инсулина) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Стварна количина инзулина која се испоручује у плућа зависиће од појединачних фактора пацијента, као што је профил протока инспирације. Ин витро, мерења емитиране аеросоле не утичу на брзину протока изнад 10 Л / мин.
врх
Клиничка фармакологија
Механизам дејства
Примарна активност инсулина је регулисање метаболизма глукозе. Инсулин снижава концентрацију глукозе у крви стимулишући периферни унос глукозе скелетним мишићима и масноћом и инхибирајући стварање јетрене глукозе. Инсулин инхибира липолизу у адипоциту, инхибира протеолизу и појачава синтезу протеина.
Фармакокинетика
Апсорпција
Екубера испоручује инсулин оралном инхалацијом. Инсулин се апсорбује једнако брзо као и субкутано давани брзи аналози инсулина и брже него супкутано давани редовни хумани инзулин код здравих испитаника и код пацијената са дијабетесом типа 1 или типа 2 (види Слика 1).
Слика 1: Средње промене у концентрацији бесплатног инсулина у серуму (µУ / мЛ) код пацијената са дијабетесом типа 2 који следе Примена појединачних доза инхалираног инсулина из Екубере (6 мг) и субкутани регуларни хумани инзулин (18У)
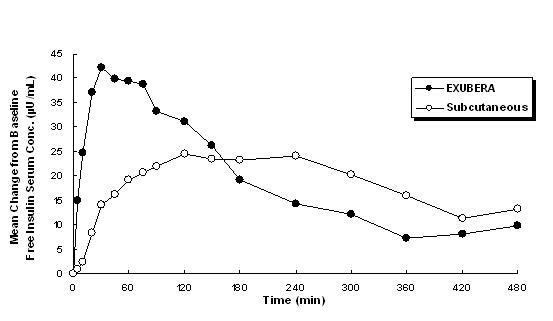
У клиничким студијама код пацијената са дијабетесом типа 1 и 2, након инхалације Екубере, серумски инсулин је достигао вршну концентрацију брже него након поткожне ињекције обичног хуманог инсулина, 49 минута (распон 30 до 90 минута) у поређењу са 105 минута (распон од 60 до 240 минута), редом.
У клиничким студијама апсорпција поткожног регуларног хуманог инсулина се смањивала са порастом индекса телесне масе пацијента (БМИ). Међутим, апсорпција инсулина након инхалације Екубера није зависила од БМИ.
У студији на здравим испитаницима, системска изложеност инсулину (АУЦ и Цмак) након примене лека Екубера се повећавала са дозом у распону од 1 до 6 мг, када се примењује као комбинације од 1 и 3 мг жуљеви.
У студији у којој је дозни облик три 1 мг блистера упоређен са једним 3 мг блистером, Цмак и АУЦ након давања три 1 мг блистера била су отприлике 30% и 40% већа од оне после примене једног 3 мг блистера (види ДОЗИРАЊЕ И АДМИНИСТРАЦИЈА).
Дистрибуција и елиминација
Пошто је рекомбинантни хумани инсулин идентичан ендогеном инсулину, очекује се да ће системска дистрибуција и елиминација бити исти. Међутим, ово није потврђено за Екубера.
Фармакодинамика
Екубера, попут супкутано примењених аналога инзулина са брзим деловањем, има бржи почетак активности за снижавање глукозе у односу на супкутано примењени хумани инзулин. У здравих добровољаца, трајање активности снижавања глукозе за Екубера било је упоредиво са поткожно примењивани редовни хумани инсулин и дуже од субкутано даваних брзо делујућих аналога инзулина (видети Слика 2).
Слика 2. Средња стопа инфузије глукозе (ГИР) Нормализована за ГИРмак за сваки предмет лечења у зависности од времена у здравим волонтерима
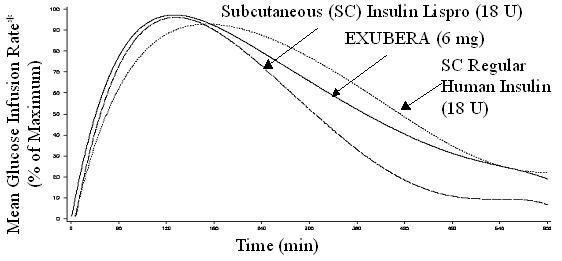
* Одређује се као количина глукозе инфузиране за одржавање константних концентрација глукозе у плазми, нормализоване на максималне вредности (проценат максималних вредности); показатељ активности инсулина.
Када се Екубера инхалира, почетак активности за снижавање глукозе код здравих добровољаца догађа се у року од 10-20 минута. Максимални ефекат на снижавање глукозе делује отприлике 2 сата након удисања. Трајање активности за снижавање глукозе је приближно 6 сати.
Код пацијената са дијабетесом типа 1 или типа 2, Екубера има већи ефекат снижавања глукозе у прва два сата након дозирања у поређењу са субкутано администрираним редовним хуманим инсулином.
Унутар субјективна варијабилност активности Екубере-а за снижавање глукозе опћенито је упоредива са оном субкутано примијењеног редовног хуманог инзулина код пацијената са дијабетесом типа 1 и 2.
Посебне популације
Педијатријски пацијенти
У деце (6-11 година) и адолесцената (12-17 година) са дијабетесом типа 1, време за максимум концентрације инсулина за Екубера било је постиже се брже него за поткожни редовни хумани инсулин, што је у складу са опажањима код одраслих пацијената са типом 1 дијабетес.
Геријатријски пацијенти
Нема очигледних разлика у фармакокинетичким својствима Екубере када упоређујемо пацијенте старије од 65 година и млађе одрасле пацијенте.
Пол
Код испитаника са и без дијабетеса нису примећене очигледне разлике у фармакокинетичким својствима Екубера између мушкараца и жена.
Трка
Испитивање је урађено на 25 здравих кавкашких и јапанских особа које нису дијабетичаре да би се упоредили фармакокинетичка и фармакодинамичка својства Екубера, насупрот поткожном убризгавању у нормалне људе инсулин. Фармакокинетичка и фармакодинамичка својства Екубера била су упоредива између две популације.
Гојазност
Апсорпција Екубере не зависи од БМИ пацијента.
Оштећење бубрега
Учинак оштећења бубрега на фармакокинетику Екубере није проучен. Пажљиво праћење глукозе и прилагођавање дозе инсулина могу бити потребни код пацијената са бубрежном дисфункцијом (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Оштећење бубрега).
Оштећење јетре
Учинак оштећења јетре на фармакокинетику Екубере није проучен. Пажљиво праћење глукозе и прилагођавање дозе инсулина могу бити потребни код пацијената са јетреном дисфункцијом (види МЕРЕ ПРЕДОСТРОЖНОСТИ).
Трудноћа
Апсорпција Екубере код трудница са гестацијским и пре гестацијским дијабетесом типа 2 била је у складу са оном код трудница са дијабетесом типа 2 (види МЕРЕ ПРЕДОСТРОЖНОСТИ).
Пушење
У пушача очекује се да ће системска изложеност инсулину Екубери бити 2 до 5 пута већа него код непушача. Екубера је контраиндицирана код пацијената који пуше или који су престали пушити мање од 6 месеци пре почетка терапије Екубером. Ако пацијент започне или настави пушити, Екубера се мора одмах прекинути због повећаног ризика од хипогликемије и мора се користити алтернативни третман (видети КОНТРАИНДИКАЦИЈЕ).
У клиничким студијама Екубере код 123 пацијента (од којих је 69 пушача) пушачи су искусили бржи почетак акције снижавања глукозе, већи максимални ефекат и већи укупни ефекат смањења глукозе (посебно током прва 2-3 сата након дозирања), у поређењу са непушачи.
Пасивни дим цигарете
Супротно повећању изложености инсулину након активног пушења, када је Екубера примењен 30 здравих добровољаца који не пуше, након 2 сати излагања пасивном диму цигарете у контролисаном експерименталном окружењу, АУЦ инсулина и Цмак инсулина смањени су за отприлике 20% и 30%, редом. Фармакокинетика Екубере није проучавана код непушача који су хронично изложени пасивном диму цигарете.
Пацијенти са основним плућним болестима
Примена Екубере код пацијената са основном плућном болешћу, попут астме или КОПБ, се не препоручује, јер безбедност и ефикасност Екубере у овој популацији нису утврђене (видети УПОЗОРЕЊА). Примена Екубера је контраиндицирана код пацијената са нестабилном или слабо контролисаном плућном болешћу, јер су широки варијације у функцији плућа које би могле утицати на апсорпцију Екубере и повећати ризик од хипогликемије или хипергликемија (види КОНТРАИНДИКАЦИЈЕ).
У фармакокинетичкој студији код 24 особе без дијабетеса са благом астмом, апсорпција инсулина након примене Екубера, у недостатку третмана бронходилататором, била је приближно 20% мања од апсорпције која је примећена код испитаника без астма. Међутим, у истраживању на 24 субјекта који нису дијабетични са хроничном опструктивном плућном болешћу (КОПБ), системска изложеност након примене Екубере била је приближно двоструко већа од оне у нормалних испитаника без КОПБ (види МЕРЕ ПРЕДОСТРОЖНОСТИ).
Примена албутерола 30 минута пре примене Екубере код особа без дијабетеса са благом астмом (н = 36) и умереном астма (н = 31) резултирала је средњим порастом АУЦ-а и Цмак инсулина за између 25 и 50% у поређењу са оним када је Екубера примењиван сам (види МЕРЕ ПРЕДОСТРОЖНОСТИ).
врх
Клиничке студије
Сигурност и ефикасност Екубера проучавана је на око 2500 одраслих пацијената са дијабетесом типа 1 и типа 2. Примарни параметар ефикасности у већини студија био је контрола гликемије, мерена редукцијом хемоглобина А1ц (ХбА1ц) са основне вриједности.
Дијабетес типа 1
Проведена је 24-недељна рандомизована, отворена студија активне контроле (студија А) код пацијената са дијабетесом типа 1 да би се проценила безбедност и ефикасност Екубера је давала пре оброка три пута дневно (ТИД) једном ноћном ињекцијом Хумулин® У Ултраленте® (суспензија цинка са продуженим хуманим инсулином) (н = 136). Упоредни третман је поткожни редовни хумани инсулин који се даје два пута дневно (БИД) (пре доручка и пре вечере) са БИД убризгавањем НПХ хуманог инсулина (суспензија људског инсулина изофана) (н = 132). У овом истраживању, просечна старост је била 38,2 године (распон: 20-64), а 52% испитаника су били мушкарци.
Друга, рандомизована, отворена студија активне контроле током 24 недеље, спроведена је код пацијената са дијабетесом типа 1 ради процене сигурност и ефикасност Екубере (н = 103) у поређењу са субкутаним регуларним људским инсулином (н = 103) када се примени ТИД пре оброци. У обе руке за лечење, НПХ људском инсулину је примењен БИД (ујутру и пре спавања) као базни инсулин. У овом истраживању, просечна старост је била 38,4 године (распон: 19-65), а 54% испитаника су били мушкарци.
У свакој студији, смањење ХбА1ц и стопе хипогликемије били су упоредиви за две групе лечења. Пацијенти који су лечени егзуберима имали су веће смањење глукозе у плазми на терет него пацијенти из упоредне групе. Проценат пацијената који достижу ниво ХбА1ц од <8% (по Акцији за лечење Америчког удружења за дијабетес) Ниво у време спровођења студије) и ниво ХбА1ц од <7% био је упоредив између две групе лечења. Резултати за Студије А и Б приказани су у Табели 2.
Табела 2: Резултати два 24-недељна, активна контрола, отворена испитивања код пацијената са дијабетесом типа 1 (студије А и Б)
| Студија А | Студија Б | |||
|---|---|---|---|---|
| Екубера (ТИД) + УЛ (КД) | СЦ Р (БИД) + НПХ (БИД) | Екубера (ТИД) + НПХ (БИД) | СЦ Р (ТИД) + НПХ (БИД) | |
| Величина узорка | 136 | 132 | 103 | 103 |
| УЛ = Хумулин® У Ултраленте®; СЦ Р = поткожни регуларни хумани инсулин | ||||
| ||||
| ХбА1ц (%) | ||||
| Основна средња вредност | 7.9 | 8.0 | 7.8 | 7.8 |
| Адј. средња промена од основне | -0.2 | -0.4 | -0.3 | -0.2 |
| Екубера минус СЦ Р* | 0.14 | -0.11 | ||
| 95% ЦИ за разлику у лечењу | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Глукоза у плазми на тесту (мг / дЛ) | ||||
| Основна средња вредност | 191 | 198 | 178 | 191 |
| Адј. средња промена од основне | -32 | -6 | -23 | 13 |
| Екубера минус СЦ Р | -27 | -35 | ||
| 95% ЦИ за разлику у лечењу | (-47, -6) | (-58, -13) | ||
| Двосатна пост-прандиална концентрација глукозе (мг / дЛ) | ||||
| Основна средња вредност | 283 | 305 | 273 | 293 |
| Адј. средња промена од основне | -21 | 14 | -1 | -3 |
| Екубера минус СЦ Р | -35 | 2 | ||
| 95% ЦИ за разлику у лечењу | (-61, -8) | (-29, 32) | ||
| Пацијенти са завршетком студије ХбА1ц < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Пацијенти са завршетком студије ХбА1ц < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Телесне тежине | ||||
| Основна средња вредност (кг) | 77.4 | 76.4 | 76.0 | 76.9 |
| Адј. средња промена од почетне (кг) | 0.4 | 1.1 | 0.4 | 0.6 |
| Екубера минус СЦ Р | -0.72 | -0.24 | ||
| 95% ЦИ за разлику у лечењу | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Крај студије дневна доза инсулина | ||||
| Инсулин кратко делујућег инсулина | 13,4 мгц | 18.3 ИУ | 10,9 мгц | 25.7 ИУ |
| Дуго делујући инсулин | 26.4 ИУ | 37.1 ИУ | 31.5 ИУ | 31,9 ИУ |
Дијабетес типа 2
Монотерапија код пацијената који нису оптимално контролисани лечењем дијетама и вежбањем
Извршена је 12-недељна, рандомизована, отворена студија активне контроле (Студија Ц) код пацијената са дијабетесом типа 2, не оптимално. контролисан дијетом и вежбањем, процењујући безбедност и ефикасност пре оброка ТИД Екубера (н = 75) у поређењу са средство за осетљивост на инсулин. У овом истраживању, просечна старост је била 53,7 година (распон: 28-80), 55% испитаника било је мушкараца, а средњи индекс телесне масе 32,3 кг / м2.
У 12 недеља, ХбА1ц нивои код пацијената лечених Екубером смањени су за 2,2% (СД = 1,0) од почетне вредности 9,5% (СД = 1,1). Проценат пацијената лечених Екубером који су достигли крај студије ХбА1ц ниво од <8% порастао је на 82,7%. Проценат пацијената лечених Екубером који су достигли крај студије ХбА1ц ниво од
Монотерапија и додатна терапија код пацијената претходно лечених оралном терапијом
Извршена је 12-недељна рандомизована, отворена студија активне контроле (студија Д) код пацијената са типом Дијабетес који су тренутно били на лечењу, али су били слабо контролисани, са два орална средства (ОА). Основне ОА укључују инзулински секретагог и метформин или тиазолидиндион. Пацијенти су насумично распоређени у једну од три руке: само настављајући ОА терапију (н = 96), прелазећи на монотерапија ТИД Екубера прије оброка (н = 102) или додавање ТИД Екубера прије оброка континуираној ОА терапији (н = 100). У овом истраживању, просечна старост је била 57,4 године (распон: 33-80), 66% испитаника било је мушкараца, а средњи индекс телесне масе 30 кг / м2.
Монотерапија Екубером и Екубера у комбинацији са ОА терапијом биле су супериорне у односу на ОА терапију само у смањењу ХбА1ц нивоа од почетне вриједности Стопе хипогликемије за две групе за лечење Екубером биле су нешто веће него у само групи ОА терапија. У поређењу са ОА терапијом, проценат пацијената који достижу ХбА1ц ниво од <8% (по акционом нивоу лечења у Америци за време дијабетеса) и ХбА1ц ниво од <7% је био већи за пацијенте лечене монотерапијом Екубера и Екубера у комбинацији са ОА терапијом. Пацијенти у обе групе за лечење Екубером имали су већа смањења глукозе у плазми нагло у односу на пацијенте који су лечени само ОА терапијом. Резултати за Студију Д приказани су у Табели 3.
Табела 3: Резултати 12-недељног, активног контролисаног, отвореног испитивања код пацијената са дијабетесом типа 2 који нису оптимално контролисани двоструком оралном терапијом (студија Д)
| Студија Д | Екубера монотерапија | ОАс* | Екубера + ОА |
|---|---|---|---|
| Величина узорка | 102 | 96 | 100 |
| |||
| ХбА1ц (%) | |||
| Основна средња вредност | 9.3 | 9.3 | 9.2 |
| Адј. средња промена од основне | -1.4 | -0.2 | -1.9 |
| Екубера група минус ОА†| -1.18†,ц, § | -1.67†, ¶, § | |
| 95% ЦИ за разлику у лечењу | (-1.41, -0.95) | (-1.90, -1.44) | |
| Глукоза у плазми на тесту (мг / дЛ) | |||
| Основна средња вредност | 203 | 203 | 195 |
| Адј. средња промена од основне | -23 | 1 | -53 |
| Екубера група минус ОА | -24ц | -53 ¶ | |
| 95% ЦИ за разлику у лечењу | (-36, -11) | (-66, -41) | |
| Пацијенти са завршетком студије ХбА1ц < 8%# | 55.9% | 18.8% | 86.0% |
| Пацијенти са завршетком студије ХбА1ц < 7% | 16.7% | 1.0% | 32.0% |
| Телесне тежине | |||
| Основна средња вредност (кг) | 89.5 | 88.0 | 88.6 |
| Адј. средња промена од почетне (кг) | 2.8 | 0.0 | 2.7 |
| Екубера група минус ОА | 2.80ц | 2.75 ¶ | |
| 95% ЦИ за разлику у лечењу | (1.94, 3.65) | (1.89, 3.61) |
Извршено је 24-недељно, рандомизовано, отворено испитивање активне контроле (студија Е) код пацијената са дијабетесом типа 2, који тренутно примају терапију сулфонилурејом. Ова студија је креирана како би се процијенила сигурност и ефикасност додавања Екубера прије оброка терапија сулфонилурејом (н = 214) у поређењу са додавањем метформина пре оброка континуираној терапији сулфонилурејом (н = 196). Субјекти су стратификовани према њиховом ХбА1ц у првој седмици. Дефинисана су два слоја: низак слој ХбА1ц (ХбА)1ц ‰ ¥ 8% до .5 9,5%) и високи ХбА1ц стратум (ХбА)1ц > 9,5 до ¤ ¤12%).
Екубера је у комбинацији са сулфонилурејом била боља од метформина и сулфонилуреје у смањењу вредности ХбА1ц од почетних у групи са високим слојем. Екубера је у комбинацији са сулфонилурејом била упоредива са метформином у комбинацији са сулфонилурејом у смањењу вредности ХбА1ц од почетних у групи са ниским слојем. Стопа хипогликемије била је већа након додавања Екубера сулфонилуреји него након додавања метформина сулфонилурее. Проценат пацијената који су достигли циљане вредности ХбА1ц од 8% и 7% био је упоредив између група лечења у обе слојеве, као и смањење глукозе у плазми на тесту (види Табела 4).
Још једна, 24-недељна, рандомизована, отворена студија активне контроле (Студија Ф) спроведена је код пацијената са дијабетесом типа 2, који тренутно примају метформинску терапију. Ова студија је креирана како би се процијенила сигурност и ефикасност додавања Екубера прије оброка терапија метформином (н = 234) у поређењу са додавањем глибенкламида пре оброка континуираној терапији метформином (н = 222). Субјекти у овој студији такође су стратификовани у један од два слоја како је дефинисано у Студији Е.
Екубера је у комбинацији са метформином била боља од глибенкламида и метформина у смањењу ХбА1ц вриједности од почетне вриједности и постизање циљаног ХбА1ц вредности у групи високог слоја. Екубера је у комбинацији са метформином била упоредива са глибенкламидом у комбинацији са метформином у смањењу ХбА1ц вриједности од почетне вриједности и постизање циљаног ХбА1ц вредности у групи са ниским слојем. Брзина хипогликемије била је незнатно виша након додавања Екубера метметину него после додавања глибенкламида у метформин. Смањење нивоа глукозе у плазми је било упоредиво међу групама за лечење (видети Табела 4).
Табела 4: Резултати два 24-недељна, активна контрола, отворена испитивања код пацијената са дијабетесом типа 2 који су претходно били на оралној терапији (студије Е и Ф)
| Студија Е | Студија Ф | |||||||
|---|---|---|---|---|---|---|---|---|
| Екубера + СУ* | Мет*+ СУ* | Екубера + СУ* | Мет*+ СУ* | Екубера + Мет* | Гли* + Мет* | Екубера + Мет* | Гли* + Мет* | |
| Висок слојâ€ | Низак слојâ€ | Висок слојâ€ | Низак слојâ€ | |||||
| Величина узорка | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| ХбА1ц (%) | ||||||||
| Основна средња вредност | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Адј. средња промена од основне | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Екубера минус ОАц | -0.38ц, § | -0.07 | -0.37ц, ¶ | 0.04 | ||||
| 95% ЦИ за разлику у лечењу | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Глукоза у плазми на тесту (мг / дЛ) | ||||||||
| Основна средња вредност | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Средња промена од почетне | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Екубера минус ОА | 1 | 4 | -2 | 4 | ||||
| 95% ЦИ за разлику у лечењу | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Испитаници са завршетком испитивања ХбА1ц < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Испитаници са завршетком испитивања ХбА1ц < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Телесне тежине | ||||||||
| Основна средња вредност (кг) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Адј. средња промена од почетне (кг) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Екубера минус ОА | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% ЦИ за разлику у лечењу | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Употреба код пацијената претходно лечених субкутаним инсулином
Извршено је 24-недељно, рандомизовано, отворено испитивање, активна контрола (Студија Г) код пацијената лечених инсулином са типом 2 дијабетеса за процену сигурности и ефикасности Екубера који је примењиван ТИД пре оброка уз једну ноћну ињекцију Хумулин® У Ултраленте® (н = 146) у поређењу са супкутаним БИД-ом који је редовно примењиван хумани инсулин (пре доручка и пре вечере) са БИД ињекцијом људског инсулина НПХ (н = 149). У овом истраживању, просечна старост је била 57,5 година (распон: 23-80), 66% испитаника било је мушкараца, а средњи индекс телесне масе 30,3 кг / м2.
Смањења од основне вриједности у ХбА1ц, проценат пацијената који досежу ХбА1ц ниво од <8% (по акционом нивоу лечења у Америци за време дијабетеса) и ХбА1ц ниво од <7%, као и стопе хипогликемије, били су слични између група лечења. Пацијенти који су лечени егзуберима имали су веће смањење глукозе у плазми на терет него пацијенти из упоредне групе. Резултати за Студију Г приказани су у Табели 5.
Табела 5: Резултати 24-недељне, активне контроле, отвореног испитивања код пацијената са дијабетесом типа 2, претходно лечених субкутаним инсулином (студија Г)
| Студија Г | Екубера (ТИД) + УЛ (КД) | СЦ Р (БИД) + НПХ (БИД) |
|---|---|---|
| Величина узорка | 146 | 149 |
| УЛ = Хумулин® У Ултраленте®; СЦ Р = поткожни регуларни хумани инсулин | ||
| ||
| ХбА1ц (%) | ||
| Основна средња вредност | 8.1 | 8.2 |
| Адј. средња промена од основне | -0.7 | -0.6 |
| Екубера минус СЦ Р* | -0.07 | |
| 95% ЦИ за разлику у лечењу | (-0.31, 0.17) | |
| Глукоза у плазми на тесту (мг / дЛ) | ||
| Основна средња вредност | 152 | 159 |
| Адј. средња промена од основне | -22 | -6 |
| Екубера минус СЦ Р | -16.36 | |
| 95% ЦИ за разлику у лечењу | (-27.09, -5.36) | |
| Пацијенти са завршетком студије ХбА1ц < 8%†| 76.0% | 69.1% |
| Пацијенти са завршетком студије ХбА1ц < 7% | 45.2% | 32.2% |
| Телесне тежине | ||
| Основна средња вредност (кг) | 90.6 | 89.0 |
| Адј. средња промена од почетне (кг) | 0.1 | 1.3 |
| Екубера минус СЦ Р | -1.28 | |
| 95% ЦИ за разлику у лечењу | (-1.96, -0.60) | |
| Крај студије дневна доза инсулина | ||
| Инсулин кратко делујућег инсулина | 16,6 мгц | 25.5 ИУ |
| Дуго делујући инсулин | 37,9 ИУ | 52.3 ИУ |
врх
Индикације и употреба
Екубера је индицирана за лечење одраслих пацијената са шећерном болешћу ради контроле хипергликемије. Екубера има почетак деловања сличан аналогима инсулина брзог деловања и има трајање активности снижавања глукозе упоредиво са супкутано администрираним људским инсулином. Код пацијената са дијабетесом типа 1, Екубера треба користити у режимима који садрже инзулин дужег деловања. Код пацијената са дијабетесом типа 2, Екубера се може користити као монотерапија или у комбинацији са оралним средствима или инсулином дужег дејства.
врх
Контраиндикације
Екубера је контраиндицирана код пацијената који су преосјетљиви на Екубера или неки од његових помоћних састојака.
Екубера је контраиндицирана код пацијената који пуше или који су престали пушити мање од 6 месеци пре почетка терапије Екубером. Ако пацијент започне или настави пушити, Екубера се мора одмах прекинути због повећаног ризика од хипогликемије и мора се користити алтернативни третман (видети КЛИНИЧКА ФАРМАКОЛОГИЈА, Специјалне популације, пушење). Сигурност и ефикасност Екубере код пацијената који пуше нису утврђени.
Екубера је контраиндицирана код пацијената са нестабилном или слабо контролисаном плућном болешћу, због великих варијација у функцији плућа што може утицати на апсорпцију Екубере и повећати ризик од хипогликемије или хипергликемија.
врх
Упозорења
Екубера се од нормалног људског инсулина разликује по брзом почетку деловања. Када се користи као инзулин током оброка, дозу Екубера треба давати у року од 10 минута пре оброка.
Хипогликемија је најчешће пријављени нежељени догађај терапије инсулином, укључујући Екубера. Време хипогликемије може да се разликује код различитих формулација инсулина.
Пацијентима са дијабетесом типа 1 такође је потребан дуже дејство инсулина да би одржали адекватну контролу глукозе.
Сваку промену инсулина треба обавити опрезно и то само под лекарским надзором. Промјене у јакости инзулина, произвођача, врсте (нпр. Обични, НПХ, аналози) или врсте (животиње, људи) могу резултирати потребом за промјеном дозе. Можда ће требати прилагодити и истовремено орално антидијабетичко лечење.
Праћење глукозе препоручује се свим пацијентима који имају дијабетес.
Због ефекта Екубере на плућну функцију, сви пацијенти морају имати плућну функцију процењену пре започињања терапије Екубером (видети МЕРЕ ПРЕДОСТРОЖНОСТИ: Плућна функција).
Примена Екубере код пацијената са основном плућном болешћу, попут астме или КОПБ, се не препоручује, јер безбедност и ефикасност Екубере у овој популацији нису утврђене (видети МЕРЕ ПРЕДОСТРОЖНОСТИ: Основна болест плућа).
У клиничким испитивањима Екубере, забиљежено је 6 ново дијагностицираних случајева примарних малигних болести плућа код пацијената лијечених Екубером и 1 ново дијагностицирани случај међу пацијентима који су третирани компаративно. Такође је објављен и један постмаркетиншки извештај о примарном малигном обољењу плућа код пацијента леченог у Екубери. У контролисаним клиничким испитивањима Екубере, инциденција новог примарног карцинома плућа на 100 пацијената током година излагања лековима била је 0,13 (5 случајева преко 3900 пацијентских година) за пацијенте лечене Екубером и 0,02 (1 случај преко 4100 пацијентских година) за компаративне лечене пацијенте. Било је премало случајева да би се утврдило да ли је појава ових догађаја повезана са Екубером. Сви пацијенти којима је дијагностикован карцином плућа су имали раније пушење цигарета.
врх
Мере предострожности
Генерал
Као и код свих инзулинских препарата, временски ток деловања Екубера може варирати код различитих појединаца или у различитом времену код исте особе. Прилагођавање дозе било ког инсулина може бити потребно ако пацијенти промене физичку активност или свој уобичајени план оброка. Потребе за инсулином могу се изменити током интерквентних стања као што су болест, емоционални поремећаји или стрес.
Хипогликемија
Као и сви инсулински препарати, хипогликемијске реакције могу бити повезане са применом Екубере. Брзе промене серумских концентрација глукозе могу изазвати симптоме сличне хипогликемији код особа са дијабетесом, без обзира на вредност глукозе. Симптоми раног упозоравања хипогликемије могу бити различити или мање изражени под одређеним условима, као што су дуго трајање дијабетеса, дијабетичке нервне болести, употреба лекова као што су бета блокатори или појачана контрола дијабетеса (види МЕРЕ ПРЕДОСТРОЖНОСТИ: Интеракције лијекова). Такве ситуације могу резултирати озбиљном хипогликемијом (и, могуће, губитком свести) пре него што пацијенти постану свесни хипогликемије.
Оштећење бубрега
Испитивања нису вршена на пацијентима са оштећењем бубрега. Као и код других инсулинских препарата, и доза код Екубере може се смањити код пацијената са оштећењем бубрега (види КЛИНИЧКА ФАРМАКОЛОГИЈА, Посебне популације).
Оштећење јетре
Испитивања нису вршена на пацијентима са оштећењем јетре. Као и код других инсулинских препарата, и доза код Екубера може се смањити код пацијената са оштећењем јетре (види КЛИНИЧКА ФАРМАКОЛОГИЈА, Посебне популације).
Алергија
Системска алергија
У клиничким студијама, укупна учесталост алергијских реакција код пацијената лечених Екубером била је слична оној код пацијената који су користили субкутане режиме са редовним хуманим инсулином.
Као и код других инсулинских препарата, може се појавити ретка, али потенцијално озбиљна генерализована алергија на инсулин, која може проузроковати осип (укључујући пруритус) по целом телу, краткоћа даха, пискање у ваздуху, смањење крвног притиска, убрзан пулс или знојење. Тешки случајеви генерализоване алергије, укључујући анафилактичке реакције, могу бити опасни по живот. Ако се такве реакције појаве од Екубере, Екубера треба прекинути и размотрити алтернативне терапије.
Производња антитела
Антитела за инсулин могу се развити током лечења свим инсулинским препаратима укључујући Екубера. У клиничким студијама Екубере где је упоређивач био супкутани инсулин, повећава се ниво антитела инсулина (што се одражава анализама активност везивања инсулина) била су значајно већа код пацијената који су примали Екубера него код пацијената који су примали поткожни инсулин само. Нису утврђене клиничке последице ових антитела током временског периода клиничких студија Екубере; међутим, дугорочни клинички значај овог повећања формирања антитела није познат.
Респираторни
Плућна функција
У клиничким испитивањима у трајању до две године, пацијенти лечени Екубером показали су већи пад плућне функције, посебно принудни волумен експиратора у једној секунди (ФЕВ1) и капацитет дифузије угљен моноксида (ДЛЦО), него третирано компаратором пацијенти. Уочена је средња разлика у групи лечења у плућној функцији која фаворизира компаративну групу првих неколико недеља лечења Екубером, а нису се мењале током двогодишњег периода лечења (Види НЕЖЕЉЕНЕ РЕАКЦИЈЕ: Плућна функција).
Током контролисаних клиничких испитивања, појединачни пацијенти су приметили опадање плућне функције у обе групе за лечење. Пад са почетне вредности ФЕВ1 од ‰ ¥ 20% код последњег посматрања догодио се код 1,5% лечених Екубером и 1,3% пацијената који су лечени компаративно. Пад од основне ДЛЦО од ‰ ¥ 20% код последњег посматрања појавило се код 5,1% лечених Екубером и 3,6% пацијената који су лечили компарацију.
Због ефекта Екубере на плућну функцију, сви пацијенти морају да имају процену спирометрије (ФЕВ1) пре него што су започели терапију Екубером. Процена ДЛЦО треба бити размотрено. Ефикасност и сигурност Екубере код пацијената са почетном ФЕВ1 или ДЛЦО <70% предвиђених није утврђено и употреба Екубера у овој популацији се не препоручује.
Препоручује се процена плућне функције (нпр. Спирометрија) после првих 6 месеци терапије, а након тога годишње, чак и ако нема плућних симптома. Код пацијената који имају пад од ‰ ¥% 20% од ФЕВ1 од почетне вриједности, тестове плућне функције треба поновити. Ако је потврђен пад од 20% од почетног ФЕВ1, Екубера треба прекинути. Присутност плућних симптома и мањи пад плућне функције могу захтевати чешће праћење плућне функције и разматрање прекида лијека Екубера.
Основна болест плућа
Примена Екубере код пацијената са основном плућном болешћу, попут астме или КОПБ, се не препоручује, јер ефикасност и сигурност Екубере у овој популацији нису утврђене.
Бронхоспазам
Бронхоспазам је ретко пријављен код пацијената који узимају Екубера. Пацијенти који доживе такву реакцију треба да прекину Екубера и одмах потраже лекарску процену. Поновна примена Екубере захтева пажљиву процену ризика и треба га обављати само под будним медицинским надзором уз доступне одговарајуће клиничке установе.
Интеркурентна респираторна болест
Екубера се примењује код пацијената са интеркурентним респираторним болестима (нпр. Бронхитисом, инфекцијама горњих дисајних путева, ринитисом) током клиничких испитивања. Код пацијената који су имали ова стања, 3-4% привремено прекида терапију Екубером. Није било повећаног ризика од хипогликемије или погоршане контроле гликемије код пацијената лечених Екубером у поређењу са пацијентима леченим поткожним инсулином. Током интеркутних респираторних болести, може бити потребно пажљиво праћење концентрација глукозе у крви и прилагођавање дозе.
Информације за пацијенте
Пацијенте треба упутити на поступке самоуправљања, укључујући праћење глукозе; правилна техника инхалације Екубера; и хипогликемија и хипергликемија. Пацијенти морају бити упућени на поступање у посебним ситуацијама као што су интерквентна стања (болест, стрес или емоционална стања) поремећаји), неадекватна или прескочена доза инсулина, ненамерна примена повећане дозе инсулина, неадекватни унос хране или прескочени оброци.
Пацијенте треба обавестити да је у клиничким студијама лечење Екубером повезано са малим, не прогресивним средњим падима плућне функције у односу на упоредни третман. Због ефекта Екубере на плућну функцију, препоручује се тестирање плућне функције пре започињања лечења Екубером. Након започињања терапије препоручују се периодични тестови плућне функције (види МЕРЕ ПРЕДОСТРОЖНОСТИ Респираторна, плућна функција).
Пацијенти би требало да обавести свог лекара ако имају историју плућних болести, јер се употреба Екубера не препоручује пацијенти са основном плућном болешћу (нпр. астма или КОПБ), а контраиндициран је код пацијената са слабо контролираним плућима болест.
Женама са дијабетесом треба упутити да обавештавају свог лекара ако су трудне или размишљају о трудноћи.
врх
Интеракције са лековима
Бројне супстанце утичу на метаболизам глукозе и могу бити потребне прилагодбе дозе инсулина и нарочито пажљив надзор.
Следе примери супстанци које могу да смање ефекат инсулина на снижавање глукозе у крви који може резултирати хипергликемијом: кортикостероиди, даназол, диазоксид, диуретици, симпатомиметичари (нпр. епинефрин, албутерол, тербуталин), деривати глукагона, изониазид, фенотиазин, соматропин, хормони штитне жлезде, естрогени, прогестогени (нпр., у оралним контрацептивима), инхибитори протеазе и атипични антипсихотички лекови (нпр. оланзапин и клозапин).
Следе примери супстанци које могу појачати ефекат инсулина на снижавање глукозе у крви и осетљивост на хипогликемију: орално антидијабетички производи, АЦЕ инхибитори, дисопирамид, фибрати, флуоксетин, МАО инхибитори, пентоксифилин, пропоксифен, салицилати и сулфонамид антибиотици
Бета блокатори, клонидин, литијумске соли и алкохол могу или повећати или смањити учинак инсулина на снижавање глукозе у крви. Пентамидин може изазвати хипогликемију, која понекад може бити праћена хипергликемијом.
Поред тога, под утицајем симпатолитичких лекова као што су бета блокатори, клонидин, гванетидин и резерпин, знакови и симптоми хипогликемије могу се смањити или изостати.
Бронходилататори и други инхалирани производи могу изменити апсорпцију инхалираног људског инсулина (видети КЛИНИЧКА ФАРМАКОЛОГИЈА, Посебне популације). Препоручује се доследно време дозирања бронходилататора у односу на примену Екубера, пажљиво праћење концентрација глукозе у крви и титрација дозе према потреби.
Канцерогенеза, мутагенеза, оштећење плодности
Двогодишње студије канцерогености на животињама нису спроведене. Инсулин није био мутаген у Амес бактеријском реверзном мутацијском тесту у присуству и одсуству метаболичке активације.
Код пацова Спрагуе-Давлеи, спроведено је 6-месечно испитивање токсичности за поновљене дозе са прахом за инхалацију инсулина у дозама до 5,8 мг / кг / дан (у поређењу са клиничким почетна доза од 0,15 мг / кг / дан, висока доза код пацова била је 39 пута или 8,3 пута већа од клиничке дозе, на основу поређења мг / кг или мг / м2 телесне површине). Код мајмуна Циномолгус, спроведено је 6-месечно испитивање токсичности са поновљеном дозом са инхалираним инсулином у дозама до 0,64 мг / кг / дан. У поређењу са клиничком почетном дозом од 0,15 мг / кг / дан, велика доза мајмуна била је 4,3 пута или 1,4 пута већа од клиничке дозе, на основу поређења мг / кг или мг / м2 телесне површине. То су биле максималне толерисане дозе засноване на хипогликемији.
У поређењу са контролним животињама, није било нежељених ефеката повезаних са лечењем било које врсте на плућну функцију, брзу или микроскопску морфологију респираторног тракта или бронхијалне лимфне чворове. Слично томе, није било ефекта на индексе пролиферације ћелија у алвеоларним или бронхиоларним пределима плућа ни код једне и друге врсте.
Пошто је рекомбинантни хумани инсулин идентичан ендогеном хормону, испитивања репродуктивне / плодности нису спроведена на животињама.
Трудноћа
Тератогени ефекти
Трудноћа Категорија Ц
Студије репродукције животиња нису спроведене са Екубером. Такође није познато да ли Екубера може нанети штету фетусу када се даје трудници или може ли Екубера утицати на репродуктивну способност. Екубера се даје трудницама само ако је то очигледно потребно.
Неговане мајке
Многи лекови, укључујући људски инсулин, излучују се из материног млека. Из тог разлога, опрез треба бити опрезан када се Екубера даје негованој жени. Пацијентима са дијабетесом који доје могу бити потребна прилагођавања дозе Екубера, плана оброка или обоје.
Педијатријска употреба
Дугорочна сигурност и ефикасност Екубере код педијатријских пацијената нису утврђене (види КЛИНИЧКА ФАРМАКОЛОГИЈА, Посебне популације).
Геријатријска употреба
У контролираним клиничким студијама Фазе 2/3 (н = 1975), Екубера је примењен на 266 пацијената старијих од 65 година и од 30 пацијената до 75 година. Већина ових пацијената имала је дијабетес типа 2. Промена ХбА1Ц и стопа хипогликемије није се разликовала према годинама.
врх
Нежељене реакције
Сигурност самог Екубере, или у комбинацији са поткожним инсулином или оралним агенсима, је била процењен је на око 2500 одраслих пацијената са дијабетесом типа 1 или типа 2 који су били изложени Екубера. Отприлике 2000 пацијената било је изложено Екубери дуже од 6 месеци, а више од 800 пацијената било је изложено више од 2 године.
Не-респираторни нежељени догађаји
Не-респираторни нежељени догађаји пријављени код ¥% 1% болесника који су лечили Екубера из 1977. године у контролисаним фазама 2/3 клиничких студија, без обзира на узрочност, укључују (али нису ограничени на) следеће:
Метаболички и хранљиви: хипогликемија (види УПОЗОРЕЊА и МЕРЕ ПРЕДОСТРОЖНОСТИ)
Тело у целини: бол у грудима
Дигестивни: сува уста
Специјална чула: отитис медиа (тип 1 педијатријски дијабетичари)
Хипогликемија
Стопе и учесталост хипогликемије били су упоредиви између Екубере и поткожног регуларног хуманог инсулина код пацијената са дијабетесом типа 1 и 2. Код пацијената типа 2 који нису адекватно контролисани терапијом једним оралним агенсом, додавање Екубера је повезана са већом стопом хипогликемије него што је било додавање друге оралне примјене агент.
Бол у грудима
За низ незнатних реакција пријављени су различити симптоми на грудима и груписани су под неспецифичним појмом боли у грудима. Ови догађаји су се десили код 4,7% пацијената лечених Екубером и 3,2% пацијената у упоредним групама. Већина (> 90%) ових догађаја је пријављена као блага или умерена. Два пацијента из Екубере и један из упоредне групе прекинули су лечење због болова у грудима. Учесталост нежељених догађаја који су били узрочно повезани са коронарном артеријском болешћу, као што су ангина пекторис или инфаркт миокарда, била је упоредна у месту Екубера (0,7% ангине пекторис; 0,7% инфаркта миокарда) и компаратора (1,3% ангине пекторис); Групе за лечење 0,7% инфаркта миокарда).
Сува уста
Забиљежена су сува уста код 2,4% болесника лијечених Екубером и 0,8% пацијената у упоредним групама. Скоро све (> 98%) пријављених сувих уста су биле благе или умерене. Ниједан пацијент није прекинуо лечење због сувих уста.
Учни догађаји код педијатријских дијабетичара
Педијатријски дијабетичари типа 1 у групама Екубера имали су чешће штетне догађаје везане за ухо него педијатријски дијабетичари типа 1 у групама за лечење који су примали само поткожни инзулин. Ови догађаји укључују и средњи отитис (Екубера 6,5%; СЦ 3,4%), бол у ушима (Екубера 3,9%; СЦ 1,4%) и поремећај ушију (Екубера 1,3%; СЦ 0%).
Респираторни нежељени догађаји
Табела 6 приказује учесталост респираторних нежељених догађаја за сваку третирану групу која је пријављена у ¥% 1% било које групе лечења у контролисаним фазама 2 и 3 клиничке студије, без обзира на узрочност.
Табела 6: Респираторни нежељени догађаји пријављени у ¥ ¥ 1% било које групе лечења у контролисаним фазама 2 и 3 клиничких студија, без обзира на узрочност
| Проценат пријављивања догађаја пацијената | |||||
|---|---|---|---|---|---|
| Нежељени догађај | Дијабетес типа 1 | Дијабетес типа 2 | |||
| Екубера Н = 698 |
СЦ Н = 705 |
Екубера Н = 1279 |
СЦ Н = 488 |
ОАс Н = 644 |
|
| СЦ = компаратор за поткожни инзулин; ОА = компаратери оралних средстава | |||||
| Инфекција респираторног тракта | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Кашаљ повећан | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Фарингитис | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Ринитис | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Синуситис | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Респираторни поремећај | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| Диспнеја | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Повећани испљувак | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Бронхитис | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Астма | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Епистакис | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Ларингитис | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Упала плућа | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Измена гласа | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Кашаљ
У 3 клиничке студије, пацијенти који су испунили упитник за кашаљ пријавили су да се кашаљ појављивао унутар секунди до минута након инхалације Екубера, била је претежно блага и јако ретко продуктивна природа. Учесталост овог кашља смањила се са наставком употребе Екубера. У контролисаним клиничким студијама, 1,2% пацијената је прекинуло лечење Екубером због кашља.
Диспнеја
Готово сви (> 97%) диспнеје су пријављени као благи или умерени. Мали број пацијената лечених Екубером (0,4%) прекинуо је лечење због диспнеје у поређењу са 0,1% пацијената који су примали компарацију.
Други респираторни нежељени догађаји - фарингитис, појачана испљувак и епистакса
Већина ових догађаја пријављена је као блага или умерена. Мали број пацијената лечених Екубером прекинуо је лечење због фарингитиса (0,2%) и повећала се испљувак (0,1%); ниједан пацијент није прекинуо лечење због епистакса.
Плућна функција
Утицај Екубере на респираторни систем процењен је на преко 3800 пацијената у контролисаним клиничким студијама фазе 2 и 3 (у којима су 1977 лечени Екубером). У рандомизираним, отвореним клиничким испитивањима у трајању до двије године, пацијенти лијечени Екубером показао је већи пад плућне функције, тачније присилни волумен експиратора у једном други (ФЕВ1) и капацитет дифузије угљен-моноксида (ДЛЦО), него код упоредних пацијената. Средње разлике у групама лечења у ФЕВ1 и ДЛЦО, примећени су током првих неколико недеља лечења Екубером, и нису напредовали током двогодишњег периода лечења. У једном завршеном контролисаном клиничком испитивању код пацијената са дијабетесом типа 2 након две године лечења Екубером, пацијенти су показали резолуцију разлике у групи лечења у ФЕВ1 шест недеља након прекида терапије. Резолуција дејства Екубере на плућну функцију код пацијената са дијабетесом типа 1 није проучавана након дуготрајног лечења.
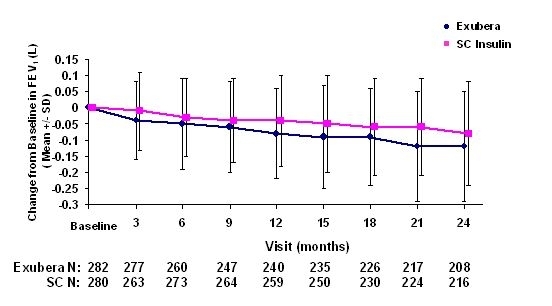
Слике 3 до 6 приказују средњу вриједност ФЕВ1 и ДЛЦО промена у односу на почетну вредност у односу на две текуће рандомизоване, отворене две године, студије на 580 пацијената са типом 1 и 620 пацијената са дијабетесом типа 2.
Слика 3: Промјена са почетне вриједности ФЕВ1 (Л) код пацијената са дијабетесом типа 1 (средње +/- стандардно одступање)
Слика 4: Промјена са почетне вриједности ФЕВ1 (Л) код пацијената са дијабетесом типа 2 (средње +/- стандардно одступање)

После 2 године лечења Екубером код пацијената са дијабетесом типа 1 и типа 2, разлика између група за третирање средња промена од почетне ФЕВ1 износила је отприлике 40 мл, фаворизирајући упоређивач.
Слика 5: Промјена са базне ДЛцо (мл / мин / ммХг) код пацијената са дијабетесом типа 1 (средње +/- стандардно одступање)

Слика 6: Промјена са базне ДЛцо (мл / мин / ммХг) код пацијената са дијабетесом типа 2 (средње +/- стандардно одступање)
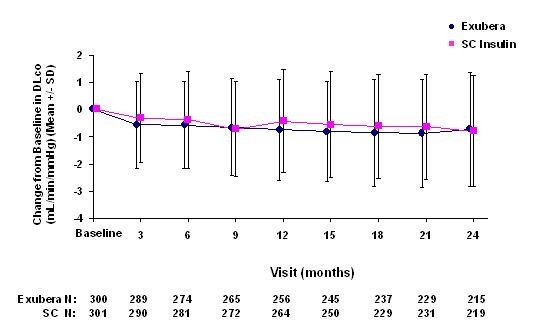
Након 2 године лечења Екубером, разлика између група лечења за средњу промену од основне ДЛЦО износила је отприлике 0,5мЛ / мин / ммХг (дијабетес типа 1), фаворизујући компаратер, и приближно 0,1мЛ / мин / ммХг (дијабетес типа 2), фаворизујући Екубера.
Током двогодишњих клиничких испитивања појединачни пацијенти су приметили опадање плућне функције у обе групе за лечење. Пад са основне ФЕВ1 од ‰ ¥ 20% у последњем опажању појавило се код 1,5% лечених Екубером и 1,3% пацијената који су лечени компаративно. Пад од основне ДЛЦО од ‰ ¥ 20% код последњег посматрања појавило се код 5,1% лечених Екубером и 3,6% пацијената који су лечили компарацију.
врх
Предозирање
Хипогликемија се може појавити као резултат вишка инзулина у односу на унос хране, потрошњу енергије или обоје.
Благе до умерене епизоде хипогликемије обично се могу лечити оралном глукозом. Можда ће бити потребно прилагођавање дозе лекова, образаца оброка или вежбања.
Тешке епизоде хипогликемије са комом, нападајем или неуролошким оштећењем могу се лечити интрамускуларним / поткожним глукагоном или концентрованом интравенском глукозом. Трајни унос угљених хидрата и проматрање могу бити потребни јер се хипогликемија може поновити након очигледног клиничког опоравка.
врх
Дозирање и администрација
Екубера, попут брзо делујућих аналога инзулина, има бржи почетак активности снижавања глукозе у поређењу са супкутано убризганим регуларним људским инсулином. Екубера има трајање активности снижавања глукозе упоредиво са супкутано ињицираним регуларним људским инсулином и дуже од инзулина који брзо делује. Дозе Екубера треба давати непосредно пре оброка (не више од 10 минута пре сваког оброка).
Код пацијената са дијабетесом типа 1, Екубера треба користити у режимима који садрже инзулин дужег деловања. За пацијенте са дијабетесом типа 2, Екубера се може користити као монотерапија или у комбинацији са оралним агенсима или инсулином дужег дејства.
Због дејства Екубере на плућну функцију, сви пацијенти би требало да се процене плућна функција пре започињања терапије Екубером. Препоручује се периодично праћење плућне функције за пацијенте који се лече Екубером (видети МЕРЕ ПРЕДОСТРОЖНОСТИ, Плућна функција).
Екубера је намењена за употребу инхалацијом и мора се примењивати искључиво Екубера® Инхалер. Односи се Водич за лекове Екубера за опис Екубере® Инхалатор и упутства о томе како користити инхалатор.
Прорачун почетне дозе егзебере пре оброка
Почетна доза Екубере треба индивидуализовати и одредити на основу савета лекара у складу са потребама пацијента. Препоручене почетне дозе пре оброка заснивају се на клиничким испитивањима у којима је од пацијената тражено да једу три оброка дневно. Почетна доза пре оброка може се израчунати следећом формулом: [Тежина (кг) Кс 0,05 мг / кг = доза пре оброка (мг)] заокружена је на најближи цели милиграм (нпр. 3,7 мг заокружено на 3 мг).
Приближне смернице за почетне дозе Екубера, пре оброка, засноване на телесној тежини пацијента, наведене су у Табели 7:
Табела 7: Приближне смернице за почетну дозу ексбебера пре оброка (на основу телесне тежине пацијента)
| Тежина пацијента (у кг) |
Тежина пацијента (у фунти) |
Почетна доза по оброку | Број 1 мг блистера по дози | Број 3 мг блистера по дози |
|---|---|---|---|---|
| 30 до 39,9 кг | 66 - 87 лб | 1 мг по оброку | 1 | - |
| 40 до 59,9 кг | 88 - 132 лб | 2 мг по оброку | 2 | - |
| 60 до 79,9 кг | 133 - 176 лб | 3 мг по оброку | - | 1 |
| 80 до 99,9 кг | 177 - 220 лб | 4 мг по оброку | 1 | 1 |
| 100 до 119,9 кг | 221 - 264 лб | 5 мг по оброку | 2 | 1 |
| 120 до 139,9 кг | 265 - 308 лб | 6 мг по оброку | - | 2 |
Блистер од 1 мг инхалационог инсулина Екубера отприлике је еквивалентан 3 ИУ супкутано ињицираног редовног хуманог инсулина. Блистер од 3 мг инхалационог инсулина Екубера отприлике је еквивалентан 8 ИУ супкутано ињицираног хуманог инзулина. Табела 8 даје приближну ИУ дозу регуларног поткожног хуманог инсулина за Екубера инхалационе дозе инзулина од 1 мг до 6 мг.
Табела 8: Приближна еквивалентна ИУ доза нормалног хуманог супкутаног инзулина за дозе инсулина инхалиране егзубером у распону од 1 мг до 6 мг
| Доза (мг) | Приближна редовна доза инсулина СЦ у ИУ | Број 1 мг Екубера блистера по дози | Број 3 мг Екубера блистера по дози |
|---|---|---|---|
| 1 мг | 3 | 1 | - |
| 2 мг | 6 | 2 | - |
| 3 мг | 8 | - | 1 |
| 4 мг | 11 | 1 | 1 |
| 5 мг | 14 | 2 | 1 |
| 6 мг | 16 | - | 2 |
Пацијенти треба да комбинују 1 мг и 3 мг блистере тако да се узме најмањи број блистера по дози (нпр., 4 мг доза треба давати као један 1 мг блистер и један 3 мг блистер). Узастопна инхалација три блистера са јединичном дозом од 1 мг доводи до знатно веће изложености инсулину у односу на инхалирање једног блистера са 3 мг јединичне дозе. Због тога се три дозе од 1 мг не смеју надоместити за једну дозу од 3 мг (видети КЛИНИЧКА ФАРМАКОЛОГИЈА, Фармакокинетика). Када се пацијент стабилише на режим дозирања који укључује 3 мг блистере и 3 мг блистере постану привремено недоступни, пацијент може привремено заменити два блистера од 1 мг једним 3 мг блистер. Потребно је пажљиво надгледати глукозу у крви.
Као и код свих инсулина, и додатни фактори које треба узети у обзир при одређивању почетне дозе Екубера укључују, али нису ограничени на пацијентову тренутну контролу гликемије, претходни одговор на инсулин, трајање дијабетеса, прехрану и вежбање навике.
Разматрања титрације дозе
После започињања терапије Екубером, као и код других средстава за снижавање глукозе, можда ће бити потребно прилагођавање дозе на основу пацијентове потребе (нпр. концентрације глукозе у крви, величина оброка и састав хранљивих састојака, доба дана и недавно или очекивано вежба). Сваком пацијенту треба титрирати оптималну дозу на основу резултата праћења глукозе у крви.
Као и за све инсулине, временски ток Екуберове акције може варирати код различитих појединаца или у различитом времену код исте јединке.
Екубера се може користити током интеркутних респираторних болести (нпр. Бронхитиса, инфекције горњих дисајних путева, ринитиса). Пажљиво праћење концентрација глукозе у крви и прилагођавање дозе могу бити потребни појединачно. Инхалиране лекове (нпр. Бронходилататоре) треба применити пре примене Екубера.
врх
Како се испоручује
Екубера (хумани инсулин [рДНА порекло]) Прашак за инхалацију доступан је у блистеру са јединичном дозом од 1 мг и 3 мг. Блистер се издаје на перфорираним картицама од шест блистера (ПВЦ / алуминијум). Две јачине се разликују по отиску у боји и тактилним ознакама које се могу разликовати додиром. Блистер од 1 мг и одговарајуће перфориране картице штампају се зеленом мастилом, а картице су обележене једном подигнутом траком. Блистер од 3 мг и одговарајуће перфориране картице штампане су плавом мастилом, а картице су обележене три подигнуте шипке.
Пет блистер карата је упаковано у провидни пластични (ПЕТ) термоформирани пладањ. Свака ПЕТ касета такође садржи средство за сушење и прекривено је прозирним пластичним (ПЕТ) поклопцем. Уложак са пет блистер картица (30 блистера са јединицом дозе) запечаћен је у врећици од ламината од фолије са средство за сушење.
Екубера (хумани инсулин [рДНА порекло]) Инхалациони прах претисни мехур, Екубера® Инхалер и замена Екубера® Јединице за пуштање потребне су да започну терапију Екубером и налазе се у пакету Екубера. Потпуно састављена Екубера® Инхалатор се састоји од базе инхалатора, коморе и Екубере® Јединица за пуштање Потпуно састављени инхалатор испоручује се са резервном комором и доступан је у комплету Екубера и као посебна јединица. Комора је доступна и као појединачна компонента.
Екубера® Јединице за пуштање се појединачно пакују у затвореној термоформираној фиоци. Једна Екубера® Јединица за ослобађање укључена је у сваки потпуно састављени Инхалер. Две додатне јединице за пуштање испоручене су у пакету Екубера и у сваком комбинованом пакету. Јединице за издање Екубера такође су доступне појединачно.
Погледајте табеле 9 и 10 за опис ових конфигурација.
Табела 9
| Екубера (хумани инсулин [рДНА порекло]) Прах за инхалацију доступан је на следећи начин: | ||
|---|---|---|
| Опис | Садржај | НДЦ |
| Екубера КИТ | 1 Екубера Инхалер 1 Замена комора 1 мг 180 180 блистера 3 мг А 90 блистера 2 Екубера® Ослободите јединице |
0069-0050-85 |
| Екубера Цомбинатион Пацк 12 | 1 мг А 90 блистера 3 мг А 90 блистера 2 Екубера® Ослободите јединице |
0069-0050-19 |
| Екубера Цомбинатион Пацк 15 | 1 мг 180 180 блистера 3 мг А 90 блистера 2 Екубера® Ослободите јединице |
0069-0050-53 |
| Екубера 1 мг пацијента | 90 А 1 мг 2 Екубера® Ослободите јединице |
0069-0707-37 |
| Екубера 3 мг паковање за пацијенте | 90 — 3 мг 2 Екубера® Ослободите јединице |
0069-0724-37 |
Табела 10
| Екубера® Инхалер и компоненте су доступни као што следи: | ||
|---|---|---|
| Опис | Садржај | НДЦ |
| Екубера® Инхалер & Цхамбер | 1 Екубера® Инхалер 1 Замена комора |
0069-0054-19 |
| Екубера® Ослободите јединице | 2 Екубера® Ослободите јединице | 0069-0097-41 |
| Екубера® Веће | 1 Замена комора | 0069-0061-19 |
Чување блистера
Није у употреби (Неотворено): Чувати на контролираној собној температури, 25 ° Ц (77 ° Ф); излети дозвољени на 15-30 ° Ц (види температуру у соби под контролом УСП-а). Не смрзавајте се. Не хладити у хладњаку.
Током употребе: Једном када се омотач фолије отвори, претисни омоти од јединичне дозе треба да буду заштићени од влаге, чувани на 25 ° Ц (77 ° Ф); излети дозвољени на 15-30 ° Ц (види температуру у соби под контролом УСП-а). Не смрзавајте се. Не хладити у хладњаку. Блистер са јединичном дозом треба користити у року од 3 месеца након отварања омота фолије. Вратите пликове у омотач да бисте заштитили од влаге. Додатно треба водити рачуна да се избегну влажна окружења, нпр. парно купатило након туширања.
Одбаците блистер ако је смрзнут.
Складиштење инхалера
Чувати на контролисаној собној температури, 25 ° Ц (77 ° Ф); излети дозвољени на 15-30 ° Ц (види температуру у соби под контролом УСП-а). Не смрзавајте се. Не хладити у хладњаку.
Тхе Екубера® Инхалер се може користити до једне године од датума прве употребе.
Замена Екубере® Јединица за пуштање
Тхе Екубера® Јединица за пуштање у Екубера® Инхалер треба мењати сваке 2 недеље.
Држати ван домашаја деце
Само Рк

ЛАБ-0331-12.0
последња ревизија 04/2008
Екубера, хумани инзулин [рДНА порекло] Информације о пацијенту (на обичном енглеском)
Детаљне информације о знаковима, симптомима, узроцима, лечењу дијабетеса
Информације у овој монографији нису намијењене покривању свих могућих употреба, упута, мјера опреза, интеракције лијекова или штетних учинака. Ове информације су уопштене и нису замишљене као посебни медицински савети. Ако имате питања о лековима које узимате или желите више информација, обратите се свом лекару, фармацеуту или медицинској сестри.
назад на: Прегледајте све лекове за дијабетес

