Јанумет за лечење дијабетеса
Робна марка: Јанумет
Опште име: Ситаглиптин и метформин хидрохлорид
Садржај:
Индикације и употреба
Дозирање и администрација
Облици и снаге дозирања
Контраиндикације
Упозорења и мере предострожности
Нежељене реакције
Интеракције са лековима
Употреба у одређеној популацији
Предозирање
Опис
Фармакологија
Неклиничка токсикологија
Клиничке студије
Како се испоручује
Информације о савјетовању пацијената
Јанумет, Ситаглиптин и Метформин хидрохлорид, информације о пацијенту (на обичном енглеском)
УПОЗОРЕЊЕ: ЛАКТИЧНА АКИДОЗА
Лактацидоза је ретка, али озбиљна компликација која може настати услед накупљања метформина. Ризик се повећава са стањима као што су сепса, дехидрација, прекомерни унос алкохола, јетрена инсуфицијенција, оштећење бубрега и акутно конгестивно затајење срца.
Напад је често суптилан, праћен само неспецифичним симптомима као што су нелагодност, миалгије, респираторни дистрес, повећање сомноленције и неспецифични трбушни невоље. Лабораторијске неправилности укључују низак пХ, повећани јаз аниона и повишен лактат у крви.
Ако се сумња на ацидозу, Јанумет1 треба прекинути и пацијента одмах хоспитализовати. [Види Упозорења и мере предострожности]
Индикације и употреба
Јанумет је индициран као додатак исхрани и вежбању ради побољшања контроле гликемије код одраслих са шећерном болешћу типа 2 када је примена лечења ситаглиптином и метформином. [Види Клиничке студије.]
Важна ограничења употребе
Јанумет се не сме користити код пацијената са дијабетесом типа 1 или за лечење дијабетичке кетоацидозе, јер у тим условима не би био ефикасан.
Јанумет није испитиван у комбинацији са инсулином.
врх
Дозирање и администрација
Препоручено дозирање
Дозирање антихипергликемијске терапије Јануметом треба индивидуализовати на основу тренутног режима пацијента, ефикасности и подношљивости уз прекорачење максималне препоручене дневне дозе од 100 мг ситаглиптина и 2000 мг метформин. Почетну комбинирану терапију или одржавање комбиниране терапије треба индивидуализирати и препустити лијечнику на дискрецију.
Јанумет се углавном треба давати два пута дневно уз оброке, уз постепено повећавање дозе, како би се смањили гастроинтестинални (ГИ) споредни ефекти због метформина.
Почетна доза Јанумет-а треба да се заснива на тренутном режиму пацијента. Јанумет треба давати два пута дневно уз оброке. Доступне су следеће дозе:
50 мг ситаглиптина / 500 мг метформин хидрохлорида
50 мг ситаглиптина / 1000 мг метформин хидрохлорида.
Пацијенти неадекватно контролирају дијету и само вежбање
Ако се терапија комбинираном таблетом која садржи ситаглиптин и метформин сматра се погодном за пацијента са шећерном болешћу типа 2 Неадекватно контролисан само дијетом и вежбањем, препоручена почетна доза је 50 мг ситаглиптина / 500 мг метформин хидрохлорида два пута дневно. Пацијентима који имају неадекватну контролу гликемије на овој дози могу се титрирати до 50 мг ситаглиптина / 1000 мг метформин хидрохлорида два пута дневно.
Пацијенти неадекватно контролирани на монотерапији метформином
Ако се терапија комбинираном таблетом која садржи ситаглиптин и метформин сматра погодном за пацијента који неадекватно контролише сам метформин, препоручена почетна доза Јанумет-а треба да даје ситаглиптин дозиран као 50 мг два пута дневно (100 мг укупне дневне дозе), а доза метформина већ је узето. За пацијенте који узимају метформин 850 мг два пута дневно, препоручена почетна доза Јанумет-а је 50 мг ситаглиптина / 1000 мг метформин хидрохлорида два пута дневно.
Пацијенти неадекватно контролисани на монотерапији ситаглиптином
Ако се терапија комбинованом таблетом која садржи ситаглиптин и метформин сматра се неадекватном за пацијента под надзором само ситаглиптина, препоручена почетна доза Јанумет-а је 50 мг ситаглиптина / 500 мг метформин хидрохлорида два пута дневно. Пацијентима са неадекватном контролом ове дозе може се титрирати до 50 мг ситаглиптина / 1000 мг метформин хидрохлорида два пута дневно. Пацијенти који узимају монотерапију ситаглиптином прилагођеном за бубрежну инсуфицијенцију не треба прелазити на Јанумет [видети Контраиндикације].
Пацијенти који прелазе са истодобне примене ситаглиптина и метформина
За пацијенте који прелазе са ситаглиптина који се примењује заједно са метформином, Јанумет може бити започет у дози ситаглиптина и метформина који су већ примљени.
Пацијенти неадекватно контролисани на двострукој комбинованој терапији било којим од следећих антихипергликемијских лекова: ситаглиптином, метформином или сулфонилурејом
Ако се терапија комбинованом таблетом која садржи ситаглиптин и метформин сматра се прикладном у овоме подешавања, уобичајена почетна доза Јанумет-а требало би да даје ситаглиптин дозиран као 50 мг два пута дневно (укупно 100 мг) дневна доза). При одређивању почетне дозе компоненте метформина треба размотрити ниво пацијента ниво гликемије и тренутну дозу (ако постоји) метформина. Треба посматрати постепену ескалацију дозе ради смањења гастроинтестиналних (ГИ) нуспојава повезаних са метформином. Пацијентима који су тренутно или започињу сулфонилуреју могу бити потребне ниже дозе сулфонилуреје да би се смањио ризик од хипогликемије [видети Упозорења и мере предострожности].
Нису изведене студије које би посебно испитивале безбедност и ефикасност Јанумет-а код пацијената претходно лечених другим оралним антихипергликемијским средствима и прешли су на Јанумет. Сваку промену у терапији дијабетеса типа 2 треба предузети са пажњом и одговарајућим надзором, јер могу доћи до промена у контроли гликемије.
врх
Облици и снаге дозирања
- 50 мг / 500 мг таблете су светло ружичасте, филмом обложене таблете у облику капсуле са утиснутим "575" са једне стране.
- 50 мг / 1000 мг таблете су црвене, филмом обложене таблете у облику капсуле са утиснутим "577" са једне стране.
врх
Контраиндикације
Јанумет (ситаглиптин / метформин ХЦл) је контраиндициран код пацијената са:
- Бубрежна болест или бубрежна дисфункција, нпр., Како то сугерирају нивои креатинина у серуму ¥ мг 1,5 мг / дЛ [мушкарци], ¥ мг 1,4 мг / дЛ [жене] или ненормално клиренс креатинина који може такође бити резултат кардиоваскуларног колапса (шок), акутног инфаркта миокарда и септикемије [види Упозорења и мере предострожности].
- Акутна или хронична метаболичка ацидоза, укључујући дијабетичку кетоацидозу, са или без коме.
- Историја озбиљне реакције преосјетљивости на Јанумет или ситаглиптин (једну од компоненти Јанумет-а), попут анафилаксије или ангиоедема. [Види Упозорења и мере предострожности и Нежељене реакције.]
Јанумет треба привремено обуставити код пацијената који су подвргнути радиолошким студијама које укључују интраваскуларне давање јодованих контрастних материја, јер употреба таквих производа може довести до акутне промене бубрега функција [види Упозорења и мере предострожности].
врх
Упозорења и мере предострожности
Млечна ацидоза
Метформин хидрохлорид
Лактацидоза је ретка, али озбиљна метаболичка компликација која може настати услед накупљања метформина током лечења Јануметом; када се догоди, фатално је отприлике у 50% случајева. Лактацидоза се такође може јавити у вези са бројним патофизиолошким стањима, укључујући дијабетес мелитус, и кад год постоји значајна ткивна хипоперфузија и хипоксемија. Лактацидозу карактеришу повишени нивои лактата у крви (> 5 ммол / Л), снижени пХ у крви, поремећаји електролита са повећаним јазом аниона и повећаним односом лактата / пирувата. Када је метформин примећен као узрок лактацидозе, углавном се проналази ниво метформин у плазми> 5 5г / мЛ.
Пријављена учесталост лактацидозе код пацијената који су примали метформин хидрохлорид је веома мала (отприлике 0,03 случаја / 1000 пацијентских година, са око 0,015 смртних случајева / 1000 године пацијента). У више од 20 000 пацијената током година изложености метформину у клиничким испитивањима, није било извештаја о лактацидози. Пријављени случајеви су се јављали првенствено код дијабетичара са значајном бубрежном инсуфицијенцијом, укључујући оба интринзична бубрега болест и бубрежна хипоперфузија, често у окружењу вишеструких пратећих медицинских / хируршких проблема и вишеструких пратећих лекови. Пацијенти са конгестивним затајењем срца који захтевају фармаколошко лечење, посебно они са нестабилном или акутна конгестивна срчана инсуфицијенција која је у ризику од хипоперфузије и хипоксемије, повећана је ризик од лактичке терапије ацидоза. Ризик од лактацидозе расте са степеном бубрежне дисфункције и годинама пацијента. Ризик од лактацидозе може се, дакле, значајно смањити редовним надзором бубрежне функције код пацијената који узимају метформин и применом минималне ефективне дозе метформина. Конкретно, лечење старијих особа треба да прати пажљиво праћење бубрежне функције. Лечење метформиномом не треба започети код пацијената старијих од 80 година, осим ако се не мери клиренс креатинина показује да се бубрежна функција не смањује, јер су ови пацијенти подложнији развоју лактацидозе. Поред тога, метформин треба брзо да се укине у присуству било ког стања повезаног са хипоксемијом, дехидрацијом или сепсом. Пошто оштећена функција јетре може значајно да ограничи способност чишћења лактата, метформин треба генерално избегавати код пацијената са клиничким или лабораторијским доказима о јетреној болести. Пацијенте треба упозорити на прекомерни унос алкохола, било акутног или хроничног, када узимају метформин, јер алкохол потенцира ефекте метформин хидрохлорида на метаболизам лактата. Поред тога, метформин треба привремено прекинути пре било ког интраваскуларног радиоконтрастног испитивања и за било који хируршки поступак [видети Упозорења и мере предострожности].
Почетак лактацидозе често је суптилан и праћен само неспецифичним симптомима као што су нелагодност, миалгије, респираторни дистрес, повећање сомноленције и неспецифични трбушни невољи. Могу бити повезане хипотермија, хипотензија и резистентне брадиаритмије са израженијом ацидозом. Пацијент и пацијентов лекар морају бити свесни могуће важности таквих симптома и пацијенту треба упутити да о томе одмах обавести лекара уколико се појаве [види Упозорења и мере предострожности]. Метформин треба повући док се ситуација не разјасни. Електролити у серуму, кетони, глукоза у крви и ако је назначено, пХ крви, ниво лактата, па чак и ниво метформина у крви могу бити корисни. Једном када се пацијент стабилише на било којем нивоу дозе метформина, гастроинтестинални симптоми који су чести током започињања терапије вероватно неће бити повезани са лековима. Каснија појава гастроинтестиналних симптома могла би бити последица лактацидозе или друге озбиљне болести.
Нивои лактата из вене у плазми нагло изнад горње границе нормале, али мањи од 5 ммол / Л код пацијената који узимају метформин, не морају нужно указивати на предстојеће лактирање ацидоза и могу се објаснити другим механизмима, као што су слабо контролисан дијабетес или гојазност, снажна физичка активност или технички проблеми у руковању узорцима [види Упозорења и мере предострожности].
Лактична ацидоза треба посумњати код сваког дијабетичара са метаболичком ацидозом која нема доказа о кетоацидози (кетонурија и кетонемија).
Лактацидоза је хитна медицинска помоћ која се мора лечити у болничким условима. Код пацијента са лактацидозом који узима метформин, лек треба одмах прекинути и одмах применити опште мере подршке. Зато што је метформин хидрохлорид подесив за дијализу (са клиренсом до 170 мЛ / мин под добрим хемодинамичким режимом стања) препоручује се брза хемодијализа ради отклањања ацидозе и уклањања нагомилане метформин. Такво управљање често резултира брзим укидањем симптома и опоравком [види Контраиндикације; Упозорења и мере предострожности].
Оштећена јетрена функција
Пошто је ослабљена функција јетре повезана са неким случајевима лактацидозе, Јанумет треба генерално избегавати код пацијената са клиничким или лабораторијским доказима јетрене болести.
Процена бубрежне функције
Зна се да се метформин и ситаглиптин значајно излучују путем бубрега. Ризик од накупљања метформина и лактацидоза расте са степеном оштећења бубрежне функције. Дакле, пацијенти са нивоом креатинина у серуму изнад горње границе нормале за свој узраст не би смели да примају Јанумет. У старијих особа Јанумет треба пажљиво титрирати да би се утврдила минимална доза за адекватан гликемијски ефекат, јер старење може бити повезано са смањеном функцијом бубрега. [Види Упозорења и мере предострожности и Употреба у одређеној популацији.]
Пре започињања терапије Јануметом и најмање једном годишње након тога, бубрежну функцију треба проценити и проверити као нормалну. Код пацијената код којих се очекује развој бубрежне дисфункције, посебно код старијих пацијената, бубрежни функцију треба чешће оцењивати и Јанумет прекинути ако постоје докази о оштећењу бубрега поклон.
Витамин Б12 Нивои
У контролисаним клиничким испитивањима метформина у трајању од 29 недеља, смањење до субнормалних нивоа раније нормалног витамина Б у серуму12 нивои, без клиничких манифестација, примећени су код отприлике 7% пацијената. Такво смањење, вероватно услед мешања у Б12 апсорпција из Б12-интрински факторски комплекс је, међутим, веома ретко повезан са анемијом и чини се да је брзо реверзибилан прекидом примене метформина или витамина Б12 суплементација Код пацијената на Јанумет-у саветује се мерење хематолошких параметара на годишњој основи и свака очигледна абнормалност треба на одговарајући начин истражити и управљати. [Види Нежељене реакције.]
Одређени појединци (они са недовољним витамином Б12 или унос или апсорпција калцијума) изгледа да су предиспонирани за развој субнормалног витамина Б12 нивоа. Код ових болесника рутински је витамин Б из серума12 мерења у интервалима од две до три године могу бити корисна.
Унос алкохола
Познато је да алкохол потенцира утицај метформина на метаболизам лактата. Стога пацијенте треба упозорити на прекомерни унос алкохола, акутног или хроничног, док примају Јанумет.
Хируршке процедуре
Употреба Јанумет-а треба привремено да се обустави за сваки хируршки поступак (осим мањих поступака који нису повезани са ограниченим уносом хране и течности) и не би требало да се поново покреће док се пацијентов орални унос не настави и бубрежна функција не процени као нормално.
Промјена у клиничком статусу пацијената с раније контролираним дијабетесом типа 2
Пацијент са дијабетесом типа 2 претходно добро контролисан на Јанумет-у који развија лабораторијске абнормалности или клиничке болест (посебно нејасна и слабо дефинисана болест) треба одмах оценити ради доказа о кетоацидози или лактацији ацидоза. Процена треба да укључује нивое електролита и кетона у серуму, нивоа глукозе у крви и, ако је назначено, пХ у крви, лактата, пирувата и метформина. Ако дође до ацидозе било ког облика, Јанумет се мора одмах зауставити и започети друге одговарајуће корективне мере.
Употреба са лековима за које је познато да изазивају хипогликемију
Ситаглиптин
Као што је типично за друга антихипергликемијска средства која се користе у комбинацији са сулфонилуреом, када се ситаглиптин користио у комбинацији са метформином и сулфонилуреа, лек за који се зна да изазива хипогликемију, учесталост хипогликемије повећана је у односу на плацебо у комбинацији са метформином и сулфонилуреа [види Нежељене реакције]. Због тога, пацијенти који такође примају инсулински секретагог (нпр. Сулфонилуреа, меглитинид) могу да захтевају нижу дозу инсулина за уклањање инсулина да би смањили ризик од хипогликемије [видети Дозирање и администрација].
Метформин хидрохлорид
Хипогликемија се не јавља код пацијената који примају метформин самостално у уобичајеним околностима употребе, али може се појавити када је калоријски унос дефицитан, напорно вежбање не надокнађује се додавањем калорија или током истодобне употребе са другим средствима за снижавање глукозе (попут сулфонилуреје и инсулина) или етанол. Старији, ослабљени или неухрањени пацијенти и они који имају инсуфицијенцију надбубрежне или хипофизе или алкохолну интоксикацију су посебно подложни хипогликемијским ефектима. Хипогликемију може бити тешко препознати код старијих особа и код људи који узимају лекове који блокирају И² адренергике.
Истовремени лекови који утичу на бубрежну функцију или диспозицију метформина
Истовремени лекови који могу утицати на бубрежну функцију или резултирати значајним хемодинамичким променама или могу ометају одлагање метформина, попут катионских лекова који се елиминишу бубрежном тубуларном секрецијом [види Интеракције са лековима], треба користити са опрезом.
Радиолошке студије са интраваскуларно јодираним контрастним материјалима
Студије интраваскуларног контраста са јодираним материјалима (на пример, интравенски урограм, интравенска холангиографија, ангиографија и скенирање рачунарске томографије (ЦТ) са интраваскуларним контрастним материјалима) може довести до акутне промене бубрежне функције и повезане су са лактацидозом код пацијената који су примали метформин [видети Контраиндикације]. Због тога, код пацијената код којих се планира таква студија, Јанумет треба привремено прекинути у време или пре процедура и одбијена 48 сати након поступка и поново успостављена тек након што се реналитира функција бубрега и установи да бити нормалан.
Хипоксичне државе
Кардиоваскуларни колапс (шок) из било којег разлога, акутно конгестивно затајење срца, акутни инфаркт миокарда и друга стања која су окарактерисана хипоксемијом повезана су са лактацидозом и могу такође да изазову пререналну болест азотемија. Када се такви догађаји појаве код пацијената на терапији Јануметом, лек треба одмах прекинути.
Губитак контроле глукозе у крви
Када је пацијент стабилизован на било којем режиму дијабетеса изложен стресу као што су грозница, траума, инфекција или операција, може доћи до привременог губитка контроле гликемије. У таквим тренуцима, можда ће бити потребно да се одузме Јанумет и привремено давање инсулина. Јанумет може бити враћен након решавања акутне епизоде.
Реакције преосјетљивости
Објављени су извјештаји о озбиљним реакцијама преосјетљивости код пацијената лијечених ситаглиптином, једном од компоненти Јанумет-а. Ове реакције укључују анафилаксију, ангиоедем и ексфолиативна стања коже укључујући Стевенс-Јохнсонов синдром. Како се ове реакције пријављују добровољно из популације несигурне величине, то је генерално није могуће поуздано проценити њихову учесталост или успоставити узрочно-посљедичну везу са излагањем лековима. Почетак ових реакција догодио се у прва 3 месеца након започињања лечења ситаглиптином, а неки извештаји су се појавили после прве дозе. Ако се сумња на реакцију преосјетљивости, прекинути лијечење Јануметом, процијенити остале потенцијалне узроке догађаја и започети алтернативно лијечење дијабетеса. [Види Нежељене реакције.]
Макроваскуларни исходи
Није било клиничких студија које би утврдиле коначне доказе о смањењу макроваскуларног ризика Јануметом или било којим другим леком против дијабетеса.
врх
Нежељене реакције
Искуство клиничких испитивања
Пошто се клиничка испитивања спроводе у веома различитим условима, стопа нежељених реакција примећена у клиничким испитивањима а лек се не може директно упоређивати са стопама у клиничким испитивањима другог лека и не мора да одражава стопе опажене у вежба.
Употреба ситаглиптина и метформина код пацијената са дијабетесом типа 2 који нису довољно контролирани на дијети и вежбању
Табела 1 резимира најчешће (‰% 5% пацијената) пријављене нежељене реакције (без обзира на процену узрока од стране истражитеља) у току 24 недеље плацебо-контролисана факторска студија у којој су ситаглиптин и метформин давани истовремено пацијентима са дијабетесом типа 2 који нису на адекватној контроли на дијети и вежбајте.
Табела 1: Ситаглиптин и метформин који се примењују истовремено код пацијената са дијабетесом типа 2 који нису довољно контролирани на дијети и вежбању: Нежељене реакције Извештавају (без обзира на процену узрока истражитеља) код) ¥ 5% пацијената који примају комбиновану терапију (и веће него код пацијената који примају Плацебо) *
| Број пацијената (%) | ||||
Плацебо |
Ситаглиптин 100 мг КД |
Метформин 500 мг / Метформин 1000 мг лицитација†|
Ситаглиптин 50 мг лицитација + Метформин 500 мг / Метформин 1000 мг лицитација†|
|
| Н = 176 | Н = 179 | Н = 364†| Н = 372†| |
| ||||
| Пролив | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Инфекције горњих дисајних путева | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Главобоља | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Ситаглиптин додатна терапија код пацијената са дијабетесом типа 2 неадекватно контролисан на метформин сам
У 24-недељном плацебо контролираном испитивању ситаглиптина од 100 мг примењеног једном дневно, додатог режиму метформина два пута дневно, није било пријављене нежељене реакције без обзира на процену истражитеља узрочно-посљедичне ситуације код 5% пацијената и чешће него код пацијената којима су дате плацебо. Прекид терапије због клиничких нежељених реакција био је сличан групи која је примала плацебо (ситаглиптин и метформин, 1,9%; плацебо и метформин, 2,5%).
Хипогликемија
Нежељене реакције хипогликемије засноване су на свим извештајима о хипогликемији; паралелно мерење глукозе није потребно. Укупна учесталост унапред специфицираних нежељених реакција хипогликемије код пацијената са дијабетесом типа 2 који нису правилно контролисани на дијети и вежбању износила је 0,6% у пацијенти који су добијали плацебо, 0,6% у болесника који су сами давали ситаглиптин, 0,8% у болесника који су сами узимали метформин, и 1,6% у болесника који су ситаглиптин добијали у комбинацији са метформин. Код пацијената са дијабетесом типа 2 који нису адекватно контролисани само метформином, укупна учесталост штетних појава реакције хипогликемије биле су 1,3% код пацијената који су примали ситаглиптин и 2,1% код пацијената који су добијали додатак плацебо.
Гастроинтестиналне нежељене реакције
Учесталост претходно одабраних нежељених гастроинтестиналних искустава код пацијената лечених ситаглиптином и метформином била је слична оним који су пријављени код пацијената лечених само метформином. Види Табелу 2.
Табела 2: Унапред одабране гастроинтестиналне нежељене реакције (без обзира на процену узрока истражитеља) пријављене код пацијената са дијабетесом типа 2 који примају ситаглиптин и метформин.
| Број пацијената (%) | ||||||
| Испитивање ситаглиптина и метформина код пацијената који нису довољно контролисани на дијети и вежбању |
Испитивање додатка Ситаглиптин код пацијената који нису довољно контролисани на метформину сам | |||||
Плацебо |
Ситаглиптин 100 мг КД |
Метформин 500 мг / Метформин 1000 мг лицитација* |
Ситаглиптин 50 мг лицитација + Метформин 500 мг / Метформин 1000 мг лицитација* |
Плацебо и Метформин ¥ мг 1500 мг дневно |
Ситаглиптин 100 мг КД и Метформин ¥ мг 1500 мг дневно |
|
| Н = 176 | Н = 179 | Н = 364 | Н = 372 | Н = 237 | Н = 464 | |
| ||||||
| Пролив | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Мучнина | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Повраћање | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Бол у стомаку†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Ситаглиптин у комбинацији са Метформином и Глимепиридом
У 24-недељној плацебо контролираној студији ситаглиптина 100 мг као додатној терапији код пацијената са дијабетесом типа 2 који нису адекватно контролисани метформином и глимепиридом (ситаглиптин, Н = 116; плацебо, Н = 113), пријављене су нежељене реакције без обзира на процену узрока од стране истражитеља код ‰% 5% пацијената лечени ситаглиптином и чешће него код пацијената лечених плацебом били су: хипогликемија (ситаглиптин, 16,4%; плацебо, 0,9%) и главобоља (6,9%, 2,7%).
Нису забележене клинички значајне промене виталних знакова или ЕКГ-а (укључујући КТц интервал) код комбинације ситаглиптина и метформина.
Најчешће нежељено искуство монотерапије ситаглиптином пријављено је без обзира на истражитеља Процена узрочности код 5% пацијената и чешће него код пацијената који су добијали плацебо назофарингитис.
Најчешће (> 5%) утврђене нежељене реакције услед почетка терапије метформином су пролив, мучнина / повраћање, надимање, нелагодност у трбуху, пробавне сметње, астенија и главобоља.
Лабораторијски тестови
Ситаглиптин
Учесталост лабораторијских нежељених реакција била је слична код пацијената лечених ситаглиптином и метформином (7,6%) у поређењу са пацијентима леченим плацебом и метформином (8,7%). У већини, али не у свим студијама, мали пораст броја белих крвних зрнаца (приближно 200 ћелија / микроЛ разлика у ВБЦ вс плацебу; опажен је средњи основни ниво ВБЦ-а од приближно 6600 ћелија / микроЛ) због малог повећања неутрофила. Ова промена у лабораторијским параметрима се не сматра клинички значајном.
Метформин хидрохлорид
У контролисаним клиничким испитивањима метформина у трајању од 29 недеља, смањење до субнормалних нивоа раније нормалног витамина Б у серуму12 нивои, без клиничких манифестација, примећени су код отприлике 7% пацијената. Такво смањење, вероватно услед мешања у Б12 апсорпција из Б12-интрински факторски комплекс је, међутим, веома ретко повезан са анемијом и чини се да је брзо реверзибилан прекидом примене метформина или витамина Б12 суплементација [Види Упозорења и мере предострожности.]
Постмаркетинг искуство
Следеће додатне нежељене реакције идентификоване су током употребе Јанумет-а или ситаглиптина, једне од компоненти Јанумет-а. Како се ове реакције пријављују добровољно из популације несигурне величине, то је генерално није могуће поуздано проценити њихову учесталост или успоставити узрочно-посљедичну везу са излагањем лековима.
Реакције преосјетљивости укључују анафилаксију, ангиоедем, осип, уртикарију, кожни васкулитис и ексфолијативна стања коже, укључујући Стевенс-Јохнсонов синдром [види Упозорења и мере предострожности]; инфекције горњих дисајних путева; повишење јетрених ензима; панкреатитис.
врх
Интеракције са лековима
Катионски лекови
Катионски лекови (нпр. Амилорид, дигоксин, морфиј, прокаинамид, кинидин, кинин, ранитидин, триамтерен, триметоприм или ванкомицин) који су елиминисани бубрежном тубуларном секрецијом теоретски имају потенцијал за интеракцију са метформином надметајући се за заједнички бубрежни тубуларни транспорт системи. Таква интеракција између метформина и оралног циметидина примећена је код нормалних здравих добровољаца и са метформином и циметидином са једном и више доза. студије интеракције лијекова, са 60% порастом вршне концентрације метформина у плазми и пуне крви и 40% повећања метформина у плазми и пуној крви АУЦ. У испитивању једноструке дозе није дошло до промене полуживота елиминације. Метформин није имао утицаја на фармакокинетику циметидина. Иако су такве интеракције и даље теоретске (осим циметидина), пажљиво праћење пацијента и прилагођавање дозе Јанумет-а и / или лекови који ометају употребу препоручују се код пацијената који узимају катионске лекове који се излучују путем секреторних проксималних бубрежних тубула систем.
Дигоксин
Дошло је до благог повећања површине испод кривуље (АУЦ, 11%) и средње највеће концентрације лекова (Ц)мак, 18%) дигоксина уз истодобну примену 100 мг ситаглиптина у трајању од 10 дана. Ова повећања се не сматрају вероватно клинички значајним. Дигоксин, као катионски лек, има потенцијал да се надмеће са метформином за уобичајене транспортне системе бубрежног тубула, утичући тако на серумске концентрације било дигоксина, метформина или оба. Пацијенте који примају дигоксин потребно је надгледати на одговарајући начин. Не препоручује се прилагођавање дозе дигоксина или Јанумет-а.
Глибуриде
У студији интеракције са једном дозом код пацијената са дијабетесом типа 2, истодобна примена метформина и глибурида није резултирала никаквим променама ни фармакокинетика метформина, ни фармакодинамика. Смањује АУЦ и Ц глибуридамак посматране су, али су веома променљиве. Природа појединачне дозе ове студије и недостатак корелације између нивоа глибурида у крви и фармакодинамичких ефеката чине клинички значај ове интеракције неизвесним.
Фуросемид
Студија интеракције лекова са једном дозом метформин-фуросемида код здравих испитаника показала је да су истодобним давањем утицаја на фармакокинетичке параметре оба једињења. Фуросемид је повећао метформин плазму и крв у Цмак за 22% и АУЦ крви за 15%, без значајних промена у бубрежном клиренсу метформина. Када се примењује са метформином, Цмак и АУЦ фуросемида су били 31% и 12% мањи, него када се дају сами, и терминални полуживот смањен је за 32%, без значајних промена у фуросемиду бубрега одобрење. Нису доступне информације о интеракцији метформина и фуросемида ако се примењују хронично.
Нифедипин
Студија интеракције лекова са метформином и нифедипином у једној дози код здравих добровољаца показала је да истодобна примена нифедипина повећава метформин Ц у плазми.мак и АУЦ за 20%, односно 9%, и повећали су количину која се излучује урином. Тмак и полуживот нису били погођени. Чини се да нифедипин повећава апсорпцију метформина. Метформин је имао минималне ефекте на нифедипин.
Употреба метформина са другим лековима
Неки лекови имају тенденцију да производе хипергликемију и могу довести до губитка контроле гликемије. Ови лекови укључују тиазиде и друге диуретике, кортикостероиде, фенотиазине, штитњаче, естрогени, орални контрацептиви, фенитоин, никотинска киселина, симпатомиметици, лекови за блокирање калцијумових канала и изониазид. Када се такви лекови дају пацијенту који прима Јанумет, пацијента треба пажљиво посматрати како би се одржала одговарајућа гликемијска контрола.
Код здравих добровољаца, фармакокинетика метформина и пропранолола, метформина и ибупрофена нису утицала на време примене у студијама интеракције у једној дози.
Метформин се занемарљиво везује за протеине плазме и, због тога је мање вероватно да ће комуницирати са лековима који су веома везани за протеин, као што су салицилати, сулфонамиди, хлорамфеникол и пробенецид, у поређењу са сулфонилуреама, који се увелико везују за серум протеина.
врх
Употреба у одређеној популацији
Трудноћа
Категорија Б трудноће:
Јанумет
Не постоје адекватне и добро контролисане студије на трудницама са Јануметом или његовим појединим компонентама; према томе, сигурност Јанумет-а код трудница није позната. Јанумет треба користити током трудноће само ако је то очигледно потребно.
Мерцк & Цо., Инц. води регистар за праћење исхода трудноће жена које су биле изложене Јанумет-у док су биле трудне. Охрабрују се здравствени радници да пријаве било какву пренаталну изложеност Јанумету позивом Регистра трудница на (800) 986-8999.
Нису спроведене студије на животињама са комбинованим производима у Јанумету ради процене ефеката на репродукцију. Следећи подаци заснивају се на налазима у студијама које се појединачно спроводе са ситаглиптином или метформином.
Ситаглиптин
Студије репродукције проведене су на пацовима и зечевима. Дозе ситаглиптина до 125 мг / кг (отприлике 12 пута више од изложености човека код највеће препоручене људске дозе) нису умањиле плодност или наштетиле плоду. Међутим, не постоје адекватна и добро контролисана испитивања ситаглиптина на трудницама.
Ситаглиптин примењиван трудним пацовима и зечевима од дана гестације 6 до 20 (органогенеза) није био тератоген у оралним дозама до 250 мг / кг (пацови) и 125 мг / кг (зечеви), односно отприлике 30 и 20 пута већа изложеност човека при највећој препорученој дози за људе (МРХД) од 100 мг / дан на основу АУЦ поређења. Веће дозе повећале су учесталост малформација ребра код потомства на 1000 мг / кг, односно отприлике 100 пута већу изложеност људи на МРХД.
Ситаглиптин примењен женкама пацова од дана гестације до 21. дана дојења смањио је телесну тежину код мушког и женског потомства за 1000 мг / кг. Није опажена функционална или бихевиорална токсичност код потомства пацова.
Плантатални пренос ситаглиптина примењен трудним пацовима био је приближно 45% у два сата и 80% у току 24 сата после дозе. Плантатални пренос ситаглиптина примењен трудним зечевима био је приближно 66% у два сата и 30% у току 24 сата.
Метформин хидрохлорид
Метформин није био тератоген код пацова и зечева у дозама до 600 мг / кг / дан. Ово представља изложеност од око 2 и 6 пута максималне препоручене дневне дозе за човек од 2.000 мг на основу поређења површине тела за пацове и зечеве. Одређивање феталних концентрација показало је делимичну плацентарну баријеру метформину.
Неговане мајке
Нису спроведена испитивања на дојећим животињама са комбинованим компонентама Јанумет-а. У студијама обављеним са појединачним компонентама, ситаглиптин и метформин се излучују у млеку пацова који доје. Није познато да ли се ситаглиптин излучује у мајчином млеку. Пошто се многи лекови излучују у људском млеку, требало би бити опрезан када се Јанумет примењује дојиљама.
Педијатријска употреба
Безбедност и ефикасност Јанумет-а код педијатријских пацијената млађих од 18 година нису утврђене.
Геријатријска употреба
Јанумет
Пошто се ситаглиптин и метформин значајно излучују путем бубрега и зато што старење може бити повезано са смањеном функцијом бубрега, Јанумет треба користити са опрезом како се старост повећава. Треба бити опрезан при одабиру дозе и треба бити заснован на пажљивом и редовном праћењу бубрежне функције. [Види Упозорења и мере предострожности; Клиничка фармакологија.]
Ситаглиптин
Од укупног броја испитаника (Н = 3884) у клиничким студијама ситаглиптина фаза ИИ и ИИИ, 725 пацијената је било старије од 65 година, док је 61 пацијент имао 75 и више година. Нису запажене укупне разлике у безбедности или ефикасности између испитаника старијих од 65 година и млађих. Иако ово и друга пријављена клиничка искуства нису идентификовале разлике у одговорима Између старијих и млађих пацијената већа осетљивост неких старијих појединаца не може бити ван правила.
Метформин хидрохлорид
Контролисане клиничке студије метформина нису укључивале довољан број старијих пацијената да би се утврдило да ли реагују другачије од млађих пацијената, мада друга пријављена клиничка искуства нису утврдила разлике у одговорима између старијих и младих пацијенти. Метформин треба користити само код пацијената са нормалном функцијом бубрега. Почетно и одржавајуће дозирање метформина требало би да буде конзервативно код пацијената у поодмаклој доби, због потенцијала смањења бубрежне функције у овој популацији. Свако прилагођавање дозе требало би да се заснива на пажљивој процени рада бубрега. [Види Контраиндикације; Упозорења и мере предострожности; и Клиничка фармакологија.]
врх
Предозирање
Ситаглиптин
Током контролисаних клиничких испитивања на здравим субјектима, примењене су једнократне дозе ситаглиптина до 800 мг. У једном испитивању примећена су максимална средња повећања КТц од 8,0 мсец у дози од 800 мг ситаглиптина, средњи ефекат који се не сматра клинички важним [видети Клиничка фармакологија]. Нема искуства са дозама изнад 800 мг код људи. У испитивањима са више доза фазе И, нису примећене клиничке нежељене реакције повезане са дозом са ситаглиптином са дозама до 400 мг дневно током периода до 28 дана.
У случају предозирања, разумно је применити уобичајене потпорне мере, нпр. Уклонити неупорбовани материјал из гастроинтестиналног система тракта, примењивати клиничко надгледање (укључујући добијање електрокардиограма) и иницирати супортивну терапију како је назначено из клиничке клинике пацијента статус.
Ситаглиптин се скромно дијализује. У клиничким студијама, отприлике 13,5% дозе је уклоњено током сесије хемодијализе у трајању од 3 до 4 сата. Ако се клинички прикладно, може се размотрити дуготрајна хемодијализа. Није познато да ли се ситаглиптин може дијализирати перитонеалном дијализом.
Метформин хидрохлорид
Дошло је до предозирања метформин хидрохлоридом, укључујући гутање количине веће од 50 грама. Хипогликемија је пријављена у отприлике 10% случајева, али није утврђена узрочна повезаност са метформин хидрохлоридом. У приближно 32% случајева предозирања метформином пријављена је лактацидоза [видети Упозорења и мере предострожности]. Метформин се може дијализовати са клиренсом до 170 мЛ / мин под добрим хемодинамичким условима. Стога хемодијализа може бити корисна за уклањање нагомиланог лека од пацијената код којих се сумња на предозирање метформином.
врх
Опис
Јанумет (ситаглиптин / метформин ХЦл) таблете садрже два орална антихипергликемијска лека која се користе у лечењу дијабетеса типа 2: ситаглиптин и метформин хидрохлорид.
Ситаглиптин
Ситаглиптин је орално активни инхибитор ензима дипептидил пептидаза-4 (ДПП-4). Ситаглиптин је присутан у таблетама Јанумет у облику ситаглиптин фосфат монохидрата. Ситаглиптин фосфат монохидрат се хемијски описује као 7 - [(3Р) - 3 - амино - 1 - оксо - 4 - (2,4,5 - трифлуорофенил) бутил] - 5,6,7,8 - тетрахидро - 3 - (трифлуорометил) - 1,2,4 - триазоло [4,3 - а] пиразин фосфат (1: 1) монохидрат са емпиријском формулом од Ц16Х15Ф6Н5О-Х3ПО4-Х2О и молекулска маса 523,32. Структурна формула је:

Ситаглиптин фосфат монохидрат је бели до готово бели, кристални, нехигроскопски прах. Растворљив је у води и Н, Н-диметил формамиду; мало растворљиво у метанолу; врло мало растворљив у етанолу, ацетону и ацетонитрилу; и нерастворљив у изопропанолу и изопропил ацетату.
Метформин хидрохлорид
Метформин хидрохлорид (Н, Н-диметилимидодикарбонимидни диамид хидрохлорид) није хемијски или фармаколошки повезан са било којом другом класом оралних антихипергликемијских средстава. Метформин хидрохлорид је бело до сиво кристално једињење са молекуларном формулом Ц4Х11Н5-ХЦл и молекулска маса 165.63. Метформин хидрохлорид је слободно растворљив у води и практично је нерастворљив у ацетону, етру и хлороформу. Тхе пКа метформина је 12,4. ПХ 1% воденог раствора метформин хидрохлорида је 6.68. Структурна формула је приказана као што је приказано:

Јанумет
Јанумет је доступан за оралну примену у облику таблета које садрже 64,25 мг ситаглиптин фосфат монохидрата и еквивалент метформин хидрохлорида до: 50 мг ситаглиптина као слободне базе и 500 мг метформин хидрохлорида (Јанумет 50 мг / 500 мг) или 1000 мг метформин хидрохлорида (Јанумет 50 мг / 1000 мг). Свака филмом обложена таблета Јанумет садржи следеће неактивне састојке: микрокристалну целулозу, поливинилпиролидон, натријум лаурил сулфат и натријум стеарил фумарат. Поред тога, филмски премаз садржи следеће неактивне састојке: поливинил алкохол, полиетилен гликол, талк, титанијум диоксид, црвени гвожђе оксид и црни гвожђе оксид.
врх
Клиничка фармакологија
Механизам дејства
Јанумет
Јанумет комбинује два антихипергликемијска средства са комплементарним механизмима деловања за побољшање контроле гликемије код пацијената са дијабетес типа 2: ситаглиптин, инхибитор дипептидил пептидазе-4 (ДПП-4) и метформин хидрохлорид, члан бигуанида класа.
Ситаглиптин
Ситаглиптин је инхибитор ДПП-4, за који се верује да врши своје деловање код пацијената са дијабетесом типа 2 успоравајући инактивацију хормона инкрета. Концентрације активних нетакнутих хормона се повећавају ситаглиптином, чиме се повећава и продужава деловање ових хормона. Инцретински хормони, укључујући глукагонски пептид-1 (ГЛП-1) и инсулинотропне зависне од глукозе полипептид (ГИП), избацује се у цревима током дана, а нивои се повећавају као одговор на оброк. Ови хормони се брзо инактивирају ензимом ДПП-4. Инцретини су део ендогеног система који учествује у физиолошкој регулацији хомеостазе глукозе. Када су концентрације глукозе у крви нормалне или повишене, ГЛП-1 и ГИП повећавају синтезу инсулина и ослобађају се из бета ћелија панкреаса интрацелуларним сигналним путевима који укључују циклични АМП. ГЛП-1 такође смањује лучење глукагона из алфа ћелија панкреаса, што доводи до смањене производње глукозе у јетри. Повећавањем и продужавањем нивоа активног инкретана, ситаглиптин повећава ослобађање инсулина и смањује ниво глукагона у циркулацији на начин зависан од глукозе. Ситаглиптин показује селективност за ДПП-4 и не инхибира активност ДПП-8 или ДПП-9 ин витро у концентрацијама приближним онима из терапијских доза.
Метформин хидрохлорид
Метформин је антихипергликемијско средство које побољшава толеранцију на глукозу код пацијената са дијабетесом типа 2, снижавајући базалну и постпрандиалну глукозу у плазми. Његови фармаколошки механизми деловања различити су од осталих класа оралних антихипергликемијских лекова. Метформин смањује производњу глукозе у јетри, смањује апсорпцију глукозе у цреву и побољшава осетљивост на инзулин повећавајући периферни унос и коришћење глукозе. За разлику од сулфонилуреје, метформин не производи хипогликемију ни код пацијената са дијабетесом типа 2, ни код нормалних испитаника (осим у посебним околностима [види Упозорења и мере предострожности]) и не изазива хиперинсулинемију. Са терапијом метформином, излучивање инсулина остаје непромењено, док ниво инсулина на тешче и целодневни одговор на инзулин у плазми могу заправо да се смање.
12.2. Фармакодинамика
Ситаглиптин
Генерал
Код пацијената са дијабетесом типа 2, примена ситаглиптина довела је до инхибиције активности ензима ДПП-4 током 24 сата. После оралног оптерећења глукозом или оброка, ова инхибиција ДПП-4 резултирала је 2- до 3-пута повећањем нивоа циркулације активног ГЛП-1 и ГИП-а, смањене концентрације глукагона и повећана реакција ослобађања инсулина на глукозу, што резултира вишим Ц-пептидом и инсулином концентрације. Пораст инзулина са смањењем глукагона повезан је са нижим концентрацијама глукозе на тесту и смањеном екскурзијом глукозе након оралног оптерећења глукозом или оброка.
Истодобна примена Ситаглиптина и Метформин хидрохлорида
У дводневном испитивању на здравим испитаницима, сам ситаглиптин повећао је активну концентрацију ГЛП-1, док је сам метформин повећао активне и укупне концентрације ГЛП-1 на сличне екстензије. Истодобна примена ситаглиптина и метформина имала је адитиван ефекат на активне концентрације ГЛП-1. Ситаглиптин, али није метформин, повећао је активну концентрацију ГИП-а. Нејасно је шта ови налази значе за промене у контроли гликемије код пацијената са дијабетесом типа 2.
У студијама са здравим испитаницима ситаглиптин није снижавао глукозу у крви нити изазвао хипогликемију.
Срчана електрофизиологија
У рандомизованој, плацебо контролираној унакрсној студији, 79 здравим субјектима је примењена појединачна орална доза ситаглиптина 100 мг, ситаглиптин 800 мг (8 пута већа од препоручене дозе) и плацебо. У препорученој дози од 100 мг, није било утицаја на КТц интервал добијен при максималној концентрацији у плазми или у било које друго време током испитивања. Након дозе од 800 мг, максимално повећање просечне промене КТц коригиране плацебом од почетне вредности у року од 3 сата након дозирања износило је 8,0 мсец. Ово повећање се не сматра клинички значајним. Када је доза од 800 мг највећа концентрација ситаглиптина у плазми била је приближно 11 пута већа од максималне концентрације после дозе од 100 мг.
Код пацијената са дијабетесом типа 2 који се узимају ситаглиптин 100 мг (Н = 81) или ситаглиптин 200 мг (Н = 63) дневно, није било значајних промена интервала КТц на основу података ЕКГ-а добијених у време очекиваног врха у плазми концентрација.
Фармакокинетика
Јанумет
Резултати студије биоеквиваленције код здравих испитаника показали су да је Јанумет (ситаглиптин / метформин ХЦл) 50 мг / 500 мг и 50 мг / 1000 мг комбиноване таблете су биоеквивалентне за истодобну примену одговарајућих доза ситаглиптина (ЈАНУВИА™2) и метформин хидрохлорид као појединачне таблете.
Апсорпција
Ситаглиптин
Апсолутна биорасположивост ситаглиптина је приближно 87%. Истодобна примена оброка са високим удјелом масти ситаглиптином није утицала на фармакокинетику ситаглиптина.
Метформин хидрохлорид
Апсолутна биорасположивост таблете метформин хидрохлорида 500 мг која се даје у тешким условима је око 50-60%. Студије које користе појединачне оралне дозе метформин хидрохлорида у таблетама од 500 мг до 1500 мг и 850 мг до 2550 мг, показују да постоји недостатак пропорционалности дозе са повећањем доза, који настаје услед смањене апсорпције, а не промене у елиминацији. Храна смањује опсег и лагано одлаже апсорпцију метформина, што показује приближно 40% нижа средња вршна концентрација у плазми (Цмак), 25% нижа површина испод кривуље концентрације у плазми у односу на време (АУЦ) и продужење времена за максималну концентрацију у плазми за 35 минута (Тмак) након примене једне 850 мг мг таблете са метформином у односу на храну, у поређењу са истом таблетом која се даје на дан. Клиничка релевантност ових смањења није позната.
Дистрибуција
Ситаглиптин
Средња запремина расподјеле у стабилном стању након једне 100 мг интравенске дозе ситаглиптина за здраве особе износи отприлике 198 литара. Фракција ситаглиптина која се реверзибилно везује за протеине у плазми је мала (38%).
Метформин хидрохлорид
Привидна запремина дистрибуције (В / Ф) метформина након појединачних оралних доза таблета метформин хидроклорида 850 мг у просеку је износила 654 ± 358 Л. Метформин се занемарљиво везује за протеине у плазми, за разлику од сулфонилурее, који су везани за више од 90% протеина. Партиције метформина у еритроците, највероватније у зависности од времена. У уобичајеним клиничким дозама и распоредима дозирања таблета метформин хидрохлорида, концентрације метформина у сталном стању се постижу у року од 24-48 сати и углавном
Метаболизам
Ситаглиптин
Отприлике 79% ситаглиптина се излучује непромењено у урину, а метаболизам је мали пут елиминације.
Након [14Ц] орална доза ситаглиптина, приближно 16% радиоактивности се излучи као метаболити ситаглиптина. Откривено је шест метаболита на нивоима у траговима и не очекује се да ће допринети инхибиторној активности ситаглиптина у плазми ДПП-4. Студије ин витро показале су да је примарни ензим одговоран за ограничени метаболизам ситаглиптина ЦИП3А4, уз допринос ЦИП2Ц8.
Метформин хидрохлорид
Интравенске студије са једном дозом код нормалних испитаника показују да се метформин излучује непромењен у мокраћа и не подлежу јетреном метаболизму (код људи нису утврђени метаболити) нити билијарном излучивање.
Излучивање
Ситаглиптин
Након оралне примјене [14Ц] доза ситаглиптина здравим испитаницима, отприлике 100% примењене радиоактивности је елиминисано изметом (13%) или урином (87%) у року од једне недеље од дозирања. Привидни терминал т1/2 Након 100 мг оралне дозе ситаглиптина било је отприлике 12,4 сата, а бубрежни клиренс је био око 350 мл / мин.
Елиминација ситаглиптина дешава се првенствено путем бубрежне екскреције и укључује активну тубуларну секрецију. Ситаглиптин је супстрат транспортера хуманог органског аниона-3 (хОАТ-3), који може бити укључен у бубрежну елиминацију ситаглиптина. Клиничка важност хОАТ-3 у транспорту ситаглиптина није утврђена. Ситаглиптин је такође супстрат п-гликопротеина, који такође може учествовати у посредовању бубрежне елиминације ситаглиптина. Међутим, циклоспорин, инхибитор п-гликопротеина, није смањио бубрежни клиренс ситаглиптина.
Метформин хидрохлорид
Бубрежни клиренс је приближно 3,5 пута већи од клиренса креатинина, што указује да је тубулна секреција главни пут елиминације метформина. Након оралне примене, око 90% апсорбованог лека се елиминише бубрежним путем током прва 24 сата, при чему је полуживот елиминације из плазме износио око 6,2 сата. Полуживот елиминације у крви је отприлике 17,6 сати, што сугерише да маса еритроцита може бити део дистрибуције.
Посебне популације
Бубрежна инсуфицијенција
Јанумет
Јанумет се не сме примењивати код пацијената са бубрежном инсуфицијенцијом [видети Контраиндикације; Упозорења и мере предострожности].
Ситаглиптин
Примећено је приближно двоструко повећање АУЦ ситаглиптина у плазми код пацијената са умереном бубрежном инсуфицијенцијом и приближно 4-пута пораст је примећен код пацијената са тешком бубрежном инсуфицијенцијом, укључујући болеснике са ЕСРД-ом на хемодијализи, у поређењу са нормалном здравом контролом субјекти.
Метформин хидрохлорид
Код пацијената са смањеном функцијом бубрега (на основу измереног клиренса креатинина), полуживот у плазми и крви метформина се продужава и бубрежни клиренс се смањује сразмерно смањењу креатинина одобрење.
Инсуфицијенција јетре
Ситаглиптин
У болесника са умереном хепатичком инсуфицијенцијом (по детету Пугх-у од 7 до 9), вредности АУЦ и Цмак ситаглиптин је порастао за отприлике 21% односно 13%, у поређењу са здравим подударним контролама након давања једне 100 мг дозе ситаглиптина. Ове разлике се не сматрају клинички значајним.
Нема клиничког искуства код пацијената са озбиљном хепатичком инсуфицијенцијом (оцена Цхилд-Пугх-а> 9).
Метформин хидрохлорид
Нису спроведена фармакокинетичка испитивања метформина код пацијената са хепатичком инсуфицијенцијом.
Пол
Ситаглиптин
Пол није имао клинички значајан утицај на фармакокинетику ситаглиптина на бази композита анализа фармакокинетичких података фазе И и популацијска фармакокинетичка анализа фазе И и фазе ИИ података.
Метформин хидрохлорид
Фармакокинетички параметри метформина нису се значајно разликовали између нормалних испитаника и пацијената са дијабетесом типа 2 када су анализирани према полу. Слично томе, у контролисаним клиничким студијама код пацијената са дијабетесом типа 2, антихипергликемијски ефекат метформина био је упоредив у мушкараца и жена.
Геријатријски
Ситаглиптин
Када се узму у обзир ефекти старости на бубрежну функцију, сама старост није клинички постојала значајан утицај на фармакокинетику ситаглиптина на основу популационе фармакокинетике анализа. Старији испитаници (65 до 80 година) имали су приближно 19% већу концентрацију ситаглиптина у плазми у односу на млађе.
Метформин хидрохлорид
Ограничени подаци контролисаних фармакокинетичких испитивања метформина код здравих старијих испитаника указују на то да је укупни плазма клиренс метформина смањен, полуживот продужен и Цмак повећава се у поређењу са здравим младим испитаницима. Из тих података произлази да се промена фармакокинетике метформина са старењем примарно објашњава променом бубрежне функције (види ГЛУЦОПХАГЕ3 прописивање информација: КЛИНИЧКА ФАРМАКОЛОГИЈА, Специјалне популације, геријатрије).
Лечење Јануметом не треба започети код пацијената старијих од 80 година, осим ако мерење клиренса креатинина не покаже да бубрежна функција није смањена [видети Упозорења и мере предострожности].
Педијатријски
Нису спроведена испитивања са Јанумет-ом на педијатријским пацијентима.
Трка
Ситаглиптин
Раса није имала клинички значајан утицај на фармакокинетику ситаглиптина на основу композитне анализе доступних фармакокинетичких података, укључујући субјекте беле, латиноамеричке, црне, азијске и друге расне природе групе.
Метформин хидрохлорид
Нису вршена испитивања фармакокинетичких параметара метформина према раси. У контролисаним клиничким студијама метформина код пацијената са дијабетесом типа 2, антихипергликемијски ефекат био је упоредив код белаца (н = 249), црнаца (н = 51) и хиспаноамериканаца (н = 24).
Индекс телесне масе (БМИ)
Ситаглиптин
Индекс телесне масе није имао клинички значајан утицај на фармакокинетику ситаглиптина на бази композита анализа фармакокинетичких података фазе И и популацијска фармакокинетичка анализа фазе И и фазе ИИ података.
Интеракције са лековима
Ситаглиптин и Метформин хидрохлорид
Дозвољена је вишеструка доза ситаглиптина (50 мг) и метформина (1000 мг) која се даје два пута дневно не значи значајну промену фармакокинетике ситаглиптина или метформина код пацијената са типом 2 дијабетес.
Студије интеракције фармакокинетичких лекова са Јануметом нису спроведене; међутим, таква истраживања су спроведена са појединачним компонентама Јанумет-а (ситаглиптин и метформин хидрохлорид).
Ситаглиптин
Ин витро процена интеракција лекова
Ситаглиптин није инхибитор ЦИП изозима ЦИП3А4, 2Ц8, 2Ц9, 2Д6, 1А2, 2Ц19 или 2Б6 и није индуктор ЦИП3А4. Ситаглиптин је п-гликопротеински супстрат, али не инхибира транспорт дигоксина посредован п-гликопротеином. На основу ових резултата сматра се мало вероватним да ситаглиптин изазива интеракцију са другим лековима који користе ове путеве.
Ситаглиптин се не везује широко за протеине плазме. Стога је склоност ситаглиптина да буде укључен у клинички значајне интеракције лекова и лекова посредованих премештањем везивања протеина у плазми врло мала.
Ин виво процена интеракција лекова
Утицај Ситаглиптина на остале лекове
У клиничким студијама, као што је описано у даљем тексту, ситаглиптин није значајно променио фармакокинетику метформина, глибурида, симвастатина, росиглитазона, варфарина или оралне употребе контрацептивни, пружајући ин виво доказе о малој склоности изазивању интеракције лекова са супстратима ЦИП3А4, ЦИП2Ц8, ЦИП2Ц9 и органским катионским транспортором (ОКТ).
Дигоксин: Ситаглиптин је имао минималан утицај на фармакокинетику дигоксина. Након давања 0,25 мг дигоксина истовремено са 100 мг ситаглиптина дневно током 10 дана, АУЦ дигоксина у плазми је повећан за 11%, а Ц у плазмимак за 18%.
Сулфонилуреје: Фармакокинетика глибурида у једној дози, супстрат ЦИП2Ц9, није значајно измењена код субјеката који су примали вишеструке дозе ситаглиптина. Не би се очекивале клинички значајне интеракције са другим сулфонилуреама (нпр. Глипизидом, толбутамидом и глимепиридом) које, попут глибурида, примарно елиминише ЦИП2Ц9 [види Упозорења и мере предострожности].
Симвастатин: Фармакокинетика појединачне дозе симвастатина, супстрата ЦИП3А4, није значајно измењена код субјеката који су примали вишеструке дневне дозе ситаглиптина. Према томе, ситаглиптин није инхибитор метаболизма посредованог ЦИП3А4.
Тиазолидиндиони: Фармакокинетика розиглитазона у једној дози није значајно промењена код испитаника примање вишеструких дневних доза ситаглиптина, што указује да ситаглиптин није инхибитор ЦИП2Ц8 посредованог метаболизам
Варфарин: Вишеструке дневне дозе ситаглиптина нису значајно промениле фармакокинетику, што је процењено мерењем С (-) или Р (+) варфарински енантиомери или фармакодинамика (процењена мерењем ИНР протромбина) једне дозе варфарин. Пошто се С (-) варфарин примарно метаболише од ЦИП2Ц9, ови подаци такође подржавају закључак да ситаглиптин није инхибитор ЦИП2Ц9.
Орални контрацептиви: Истодобна примена ситаглиптина није значајно изменила фармакокинетику стабилног стања норетиндрона или етинил естрадиола.
Утицај других лекова на Ситаглиптин
Клинички подаци описани у даљем тексту сугеришу да ситаглиптин није подложан клинички значајним интеракцијама лековима који се примењују истовремено.
Циклоспорин: Испитивање је спроведено за процену утицаја циклоспорина, моћног инхибитора п-гликопротеина, на фармакокинетику ситаглиптина. Истодобна примена једне 100 мг оралне дозе ситаглиптина и једне 600 мг оралне дозе циклоспорина повећала је АУЦ и Цмак ситаглиптина за отприлике 29%, односно 68%, респективно. Ове скромне промене фармакокинетике ситаглиптина нису се сматрале клинички значајним. Бубрежни клиренс ситаглиптина такође није значајно измењен. Стога се не могу очекивати значајне интеракције са другим инхибиторима п-гликопротеина.
Метформин хидрохлорид
[Види Интеракције са лековима]
врх
Неклиничка токсикологија
Канцерогенеза, мутагенеза, оштећење плодности
Јанумет
Нису спроведене студије на животињама са комбинованим производима у Јанумету за процену карциногенезе, мутагенезе или оштећења плодности. Следећи подаци заснивају се на налазима у студијама ситаглиптина и метформина појединачно.
Ситаглиптин
Проведено је двогодишње истраживање канцерогености код мужјака и женки пацова којима су даване оралне дозе ситаглиптина од 50, 150 и 500 мг / кг / дан. Појачана је учесталост комбинованог аденома / карцинома јетре код мушкараца и жена и карцинома јетре код жена са 500 мг / кг. Ова доза доводи до изложености отприлике 60 пута веће од изложености човека при максималној препорученој дневној дози за одрасле људе (МРХД) од 100 мг / дан на основу АУЦ поређења. Тумори јетре нису примећени са 150 мг / кг, што је приближно 20 пута више од изложености људи МРХД-у. Проведено је двогодишње истраживање канцерогености код мушких и женских мишева којима су даване оралне дозе ситаглиптина од 50, 125, 250 и 500 мг / кг / дан. Није било повећања инциденције тумора у било којем органу до 500 мг / кг, отприлике 70 пута више од изложености људи на МРХД. Ситаглиптин није био мутаген или кластоген са или без метаболичке активације у Амесовом испитивању бактеријске мутагености, јајнику кинеског хрчка (ЦХО) тест аберације хромозома, тест ин витро цитогенетике у ЦХО, тест алкалне елуције алкалне ДНК ин витро штакора и ин виво микронуклеус тест.
У студијама плодности штакора оралним дозним дозама од 125, 250 и 1000 мг / кг, мужјаци су третирани 4 недеље пре парења, током парење, до заказаног престанка (отприлике 8 недеља укупно), а женке су третиране 2 недеље пре парења кроз гестацију 7. дан Није примећен штетан утицај на плодност при 125 мг / кг (отприлике 12 пута изложеност човеку при МРХД од 100 мг / дан на основу АУЦ поређења). Код већих доза примећене су повећане ресорпције код жена које нису повезане са дозом (приближно 25 и 100 пута изложеност људи МРХД-у на основу АУЦ поређења).
Метформин хидрохлорид
Проведена су дуготрајна испитивања канцерогености на пацовима (трајање дозирања од 104 недеље) и мишевима (трајање дозирања од 91 недеље) у дозама до и укључујући 900 мг / кг / дан и 1500 мг / кг / дан, редом. Обе дозе су отприлике четири пута веће од максималне препоручене дневне дозе за човек од 2000 мг на основу упоређивања површине тела. Нису пронађени докази о канцерогености метформином ни код мушких ни код женских мишева. Слично томе, код мужјака пацова није примећен туморигенски потенцијал са метформином. Међутим, постојала је повећана учесталост бенигних стромалних полипа материце код женки пацова који су третирани са 900 мг / кг / дан.
Није било доказа о мутагеном потенцијалу метформина у следећим ин витро тестовима: Амесов тест (С. тифимуријум), тест мутације гена (ћелије мишјих лимфома) или тест хромосомских аберација (хумани лимфоцити). Резултати ин виво теста микронуклеуса на мишу су такође били негативни. На плодност мужјака или женки пацова метформин није утицао када су га давали у дозама већим од 600 мг / кг / дан, која је отприлике три пута већа од максималне препоручене дневне дозе за човека на основу површине тела поређења.
врх
Клиничке студије
Употреба ситаглиптина и метформина проучавана је код пацијената са дијабетесом типа 2 који нису довољно контролисани на дијети и вежбању и у комбинацији са глимепиридом.
Није било клиничких студија ефикасности спроведених са Јанумет-ом; међутим, показана је биоеквиваленција Јанумет-а са таблетама ситаглиптина и метформин хидрохлорида.
Употреба ситаглиптина и метформина код пацијената са дијабетесом типа 2 који нису довољно контролирани на дијети и вежбању
Укупно 1091 пацијент са дијабетесом типа 2 и неадекватном контролом гликемије на дијети и вежбању учествовало је у току 24 недеље, рандомизована, двоструко слепа, фактористичка студија плацебо контролисана за процену ефикасности ситаглиптина и метформина ко-администрација. Пацијенти на антихипергликемијском средству (Н = 541) били су подвргнути дијети, вежбању и периоду испирања лекова до 12 недеља. Након периода испирања, пацијенти са неадекватном контролом гликемије (А1Ц 7,5% до 11%) рандомизирани су након што су завршили двонедељни појединачни слепи плацебо. Пацијенти који на почетку испитивања не узимају антихипергликемијске лекове (Н = 550) са неадекватном контролом гликемије (А1Ц 7,5% до 11%) одмах је ушло у двонедељни период једнократног слепог плацеба, а затим су били рандомизовани. Отприлике једнак број пацијената рандомизиран је да прима плацебо, 100 мг ситаглиптина једном дневно, 500 мг или 1000 мг метформина два пута дневно или 50 мг ситаглиптина два пута дневно у комбинацији са 500 мг или 1000 мг метформина два пута дневно. Пацијенти који током студије нису испунили специфичне гликемијске циљеве лечени су спасавањем глибурида (глибенкламида).
Истодобна примена ситаглиптина и метформина обезбедила је значајна побољшања у А1Ц, ФПГ и двочасовном ППГ у поређењу са плацебом, самим метформином и ситаглиптином (Табела 3, Слика 1). Средња смањења од основне вриједности у А1Ц-у су углавном била већа за пацијенте са вишим почетним вриједностима А1Ц. За пацијенте који на почетку испитивања нису узимали антихипергликемијско средство, средња снижења од основне вредности у А1Ц била су: 100 мг ситаглиптина једном дневно, -1,1%; лицитација метформина од 500 мг, -1,1%; понуда метформина 1000 мг, -1,2%; ситаглиптин од 50 мг, са метформином, 500 мг, -1,6%; ситаглиптин од 50 мг, са понудом метформина од 1000 мг, -1,9%; а за пацијенте који примају плацебо -0,2%. Липидни ефекти су углавном неутрални. Смањење телесне тежине у групама које су давале ситаглиптин у комбинацији са метформином било је слично оном у групама које су дале само метформин или плацебо.
Табела 3: Гликемијски параметри код завршне посете (24-недељна студија) за Ситаглиптин и Метформин, сам и у комбинацији код пацијената са дијабетесом типа 2, који нису довољно контролирани на дијети и вежбању *
Плацебо |
Ситаглиптин 100 мг КД |
Метформин 500 мг понуда |
Метформин 1000 мг понуда |
Ситаглиптин 50 мг лицитација + Метформин 500 мг понуда |
Ситаглиптин 50 мг лицитација + Метформин 1000 мг понуда |
|
| ||||||
| А1Ц (%) | Н = 165 | Н = 175 | Н = 178 | Н = 177 | Н = 183 | Н = 178 |
| Основна линија (средња вредност) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Промена од почетне (прилагођена средња вредност)†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Разлика од плацеба (прилагођена средња вредност)†) (95% ЦИ) |
-0.8ц (-1.1, -0.6) |
-1.0ц (-1.2, -0.8) |
-1.3ц (-1.5, -1.1) |
-1.6ц (-1.8, -1.3) |
-2.1ц (-2.3, -1.8) |
|
| Пацијенти (%) који постижу А1Ц <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Пацијенти који примају спасилачке лекове | 32 | 21 | 17 | 12 | 8 | 2 |
| ФПГ (мг / дЛ) | Н = 169 | Н = 178 | Н = 179 | Н = 179 | Н = 183 | Н = 180 |
| Основна линија (средња вредност) | 196 | 201 | 205 | 197 | 204 | 197 |
| Промена од почетне (прилагођена средња вредност)†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Разлика од плацеба (прилагођена средња вредност)†) (95% ЦИ) |
-23ц (-33, -14) |
-33ц (-43, -24) |
-35ц (-45, -26) |
-53ц (-62, -43) |
-70ц (-79, -60) |
|
| Двочасовни ППГ (мг / дЛ) | Н = 129 | Н = 136 | Н = 141 | Н = 138 | Н = 147 | Н = 152 |
| Основна линија (средња вредност) | 277 | 285 | 293 | 283 | 292 | 287 |
| Промена од почетне (прилагођена средња вредност)†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Разлика од плацеба (прилагођена средња вредност)†) (95% ЦИ) |
-52ц (-67, -37) |
-54ц (-69, -39) |
-78ц (-93, -63) |
-93ц (-107, -78) |
-117ц (-131, -102) |
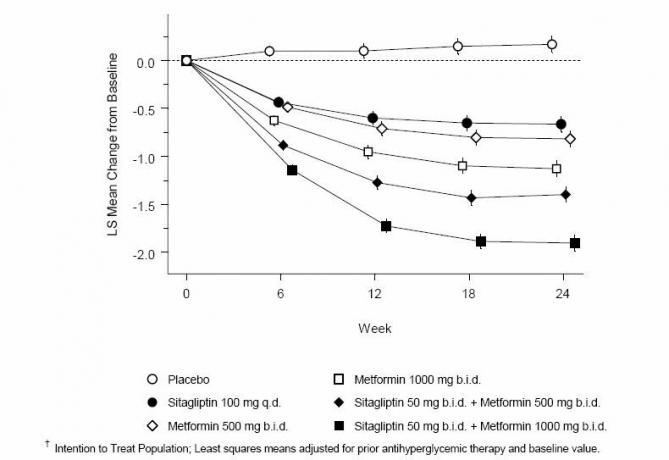
Слика 1: Просечна промена од почетне вредности за А1Ц (%) током 24 недеље са Ситаглиптином и Метформином, сама и у комбинацији са пацијентима са дијабетесом типа 2 који нису довољно контролирани дијетом и вјежбањем
Поред тога, ово истраживање је обухватило болеснике (Н = 117) са тежом хипергликемијом (А1Ц> 11% или крв) глукоза> 280 мг / дЛ) који су третирани два пута дневно ситаглиптин 50 мг и метформин 1000 мг. У овој групи болесника, средња основна вредност А1Ц била је 11,2%, средња вредност ФПГ била је 314 мг / дЛ, а средња двочасовна ППГ била је 441 мг / дЛ. Након 24 недеље примећено је просечно смањење од почетне вредности од -2,9% за А1Ц, -127 мг / дЛ за ФПГ и -208 мг / дЛ за 2-сатни ППГ.
Почетна комбинирана терапија или одржавање комбиниране терапије треба индивидуализирати и препустити се дискрецијском рјешењу здравственог радника.
Ситаглиптин додатна терапија код пацијената са дијабетесом типа 2 неадекватно контролисан на метформин сам
Укупно 701 пацијент са дијабетесом типа 2 учествовало је у 24-недељној, рандомизованој, двоструко слепој, плацебо-контролираној студији осмишљеној за процену ефикасности ситаглиптина у комбинацији са метформином. Пацијенти који су већ узимали метформин (Н = 431) у дози од најмање 1500 мг дневно, рандомизирани су након што су завршили двонедељни, једно-слепи плацебо. Пацијенти на метформину и другом антихипергликемијском средству (Н = 229) и пацијенти који не узимају било која антихипергликемијска средства (ван терапије најмање 8 недеља, Н = 41) били су насумични након периода отприлике 10 недеља метформина (у дози од најмање 1500 мг дневно) у монотерапија. Пацијенти су рандомизирани на додавање 100 мг ситаглиптина или плацеба, који се дају једном дневно. Пацијенти који током студија нису испунили одређене гликемијске циљеве лечени су спасавањем пиоглитазона.
У комбинацији са метформином, ситаглиптин је значајно побољшао А1Ц, ФПГ и двочасовни ППГ у поређењу са плацебом и метформином (Табела 4). Спасилачка терапија гликемије коришћена је код 5% пацијената лечених 100 мг ситаглиптина и 14% пацијената лечених плацебом. За обе групе лечења примећено је слично смањење телесне тежине.
Табела 4: Гликемијски параметри код завршне посете (24-недељно истраживање) ситаглиптина у додатној комбинованој терапији метформином *
| Ситаглиптин 100 мг КД + Метформин |
Плацебо + Метформин |
|
| ||
| А1Ц (%) | Н = 453 | Н = 224 |
| Основна линија (средња вредност) | 8.0 | 8.0 |
| Промена од почетне (прилагођена средња вредност)†) | -0.7 | -0.0 |
| Разлика од плацеба + метформина (прилагођени средњи износ)†) (95% ЦИ) |
-0.7ц (-0.8, -0.5) |
|
| Пацијенти (%) који постижу А1Ц <7% | 213 (47%) | 41 (18%) |
| ФПГ (мг / дЛ) | Н = 454 | Н = 226 |
| Основна линија (средња вредност) | 170 | 174 |
| Промена од почетне (прилагођена средња вредност)†) | -17 | 9 |
| Разлика од плацеба + метформина (прилагођени средњи износ)†) (95% ЦИ) |
-25ц (-31, -20) |
|
| Двочасовни ППГ (мг / дЛ) | Н = 387 | Н = 182 |
| Основна линија (средња вредност) | 275 | 272 |
| Промена од почетне (прилагођена средња вредност)†) | -62 | -11 |
| Разлика од плацеба + метформина (прилагођени средњи износ)†) (95% ЦИ) |
-51ц (-61, -41) |
Ситаглиптин додатна терапија код пацијената са дијабетесом типа 2 неадекватно контролисана у комбинацији метформина и глимепирида
Укупно 441 пацијент са дијабетесом типа 2 учествовао је у 24 седмици, рандомизовано, двоструко слепо, плацебо-контролисана студија дизајнирана за процену ефикасности ситаглиптина у комбинацији са глимепиридом, са или без метформина. Пацијенти су ушли у почетни период лечења глимепиридом (‰ мг 4 мг дневно) или глимепиридом у комбинацији са метформином (¥ мг 1500 мг дневно). После периода титрације дозе и периода стабилног дозе до 16 недеља и периода у коме су се налазили плацебо од 2 недеље, пацијенти са неадекватним гликемијска контрола (А1Ц 7,5% до 10,5%) је рандомизована на додавање 100 мг ситаглиптина или плацеба, примењених једном дневно. Пацијенти који током студија нису испунили одређене гликемијске циљеве лечени су спасавањем пиоглитазона.
Пацијенти који су примали ситаглиптин са метформином и глимепиридом имали су значајна побољшања у А1Ц и ФПГ у поређењу са пацијентима који су примали плацебо са метформином и глимепиридом (Табела 5), са средњим смањењима од почетне у односу на плацебо у А1Ц од -0,9% и у ФПГ од -21 мг / дЛ Спасилачка терапија примењена је у 8% пацијената лечених 100 мг ситаглиптина и 29% пацијената лечених додатком плацеба. Пацијенти лечени додатком ситаглиптина имали су просечно повећање телесне тежине од 1,1 кг у односу на додатак плацебо (+0,4 кг вс. -0,7 кг). Поред тога, ситаглиптин са додатком је резултирао повећаном стопом хипогликемије у поређењу са плацебом. [Види Упозорења и мере предострожности; Нежељене реакције.]
Табела 5: Гликемијски параметри у завршној посети (24-недељно истраживање) за ситаглиптин у комбинацији са метформином и глимепиридом *
| Ситаглиптин 100 мг + Метформин и Глимепирид |
Плацебо + Метформин и Глимепирид |
|
| ||
| А1Ц (%) | Н = 115 | Н = 105 |
| Основна линија (средња вредност) | 8.3 | 8.3 |
| Промена од почетне (прилагођена средња вредност)†) | -0.6 | 0.3 |
| Разлика од плацеба (прилагођена средња вредност)†(95% ЦИ) | -0.9ц (-1.1, -0.7) |
|
| Пацијенти (%) који постижу А1Ц <7% | 26 (23%) | 1 (1%) |
| ФПГ (мг / дЛ) | Н = 115 | Н = 109 |
| Основна линија (средња вредност) | 179 | 179 |
| Промена од почетне (прилагођена средња вредност)†) | -8 | 13 |
| Разлика од плацеба (прилагођена средња вредност)†(95% ЦИ) | -21ц (-32, -10) |
Ситаглиптин додатак терапији вс. Глипизидна терапија код пацијената са дијабетесом типа 2 неадекватно је контролисана метформином
Ефикасност ситаглиптина процењена је у двонедељном, двоструко слепом испитивању неинфериорности са контролираним глипизидом код пацијената са дијабетесом типа 2. Пацијенти који нису на лечењу или другим антихипергликемијским средствима ушли су у период лечења до 12 недеља монотерапијом метформином (доза ‰ мг 1500 мг дневно) која укључује испирање лекова који нису метформин, ако применљиво. После периода у којем су се налазили, они са неадекватном гликемијском контролом (А1Ц 6,5% до 10%) рандомизовани су 1: 1 са додатком ситаглиптина 100 мг једном дневно или глипизида током 52 недеље. Пацијентима који су примали глипизид дана је почетна доза од 5 мг / дан, а затим је изборно титрована током наредних 18 недеља до максималне дозе од 20 мг / дан, колико је потребно за оптимизацију контроле гликемије. Након тога, доза глипизида је требало да остане константна, осим за смањивање титрације ради спречавања хипогликемије. Средња доза глипизида после периода титрације била је 10 мг.
Након 52 недеље, ситаглиптин и глипизид имали су сличне просечне редукције од почетне вредности у А1Ц у анализи за лечење (Табела 6). Ови резултати били су у складу са анализом по протоколу (Слика 2). Закључак у корист не-инфериорности ситаглиптина у односу на глипизид може бити ограничен на пацијенте са почетном вриједности А1Ц упоредив са онима укљученим у студију (преко 70% пацијената имало је основну вриједност А1Ц <8% и преко 90% је имало А1Ц <9%).
Табела 6: Гликемијски параметри у истраживању током 52 недеље који упоређују ситаглиптин са глипизидом као додатну терапију код пацијената који неадекватно контролишу метформин (намера за лечење популације) *
| Ситаглиптин 100 мг + Метформин |
Глипизиде + Метформин |
|
| ||
| А1Ц (%) | Н = 576 | Н = 559 |
| Основна линија (средња вредност) | 7.7 | 7.6 |
| Промена од почетне (прилагођена средња вредност)†) | -0.5 | -0.6 |
| ФПГ (мг / дЛ) | Н = 583 | Н = 568 |
| Основна линија (средња вредност) | 166 | 164 |
| Промена од почетне (прилагођена средња вредност)†) | -8 | -8 |
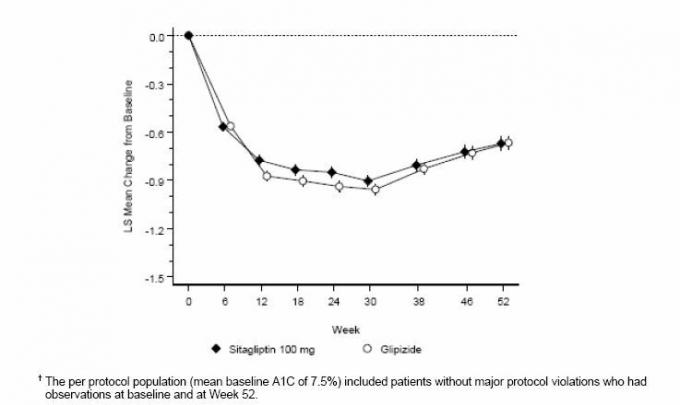
Слика 2: Средња промена од основне линије за А1Ц (%) преко 52 недеље у студији која упоређује Ситаглиптин са Глипизид као додатна терапија код пацијената који неадекватно контролишу метформин (по протоколу) â€
Инциденција хипогликемије у ситаглиптиновој групи (4,9%) била је значајно (п <0,001) нижа од оне у групи са глипизидом (32,0%). Пацијенти лечени ситаглиптином показали су значајно просечно смањење телесне тежине од основне вредности у поређењу са значајним повећањем телесне тежине код пацијената који су примењивали глипизид (-1,5 кг у односу на +1.1 кг).
врх
Како се испоручује
Бр. 6747 - Таблете Јанумет, 50 мг / 500 мг, светло су ружичасте, филмом обложене таблете у облику капсуле са утиснутим на једној страни "575". Они се испоручују на следећи начин:
НДЦ 0006-0575-61 боца са 60 употребних јединица
НДЦ 0006-0575-62 од 180 употребљивих боца
НДЦ 0006-0575-52 блистер паковања од 50 јединица
НДЦ 0006-0575-82 боце од 1000 сировина.
Бр. 6749 - Таблете Јанумет, 50 мг / 1000 мг, црвене су, филмом обложене таблете у облику капсуле са утиснутим на једној страни "577". Они се испоручују на следећи начин:
НДЦ 0006-0577-61 од 60 употребљивих боца
НДЦ 0006-0577-62 од 180 употребљивих боца
НДЦ 0006-0577-52 блистер паковања од 50 јединица
НДЦ 0006-0577-82 боце од 1000 сировина.
Чувајте на 20-25 ° Ц (68-77 ° Ф), дозвољени излети на 15-30 ° Ц (59-86 ° Ф).
врх
Информације о савјетовању пацијената
Упутства
Пацијенте треба информисати о потенцијалним ризицима и предностима Јанумет-а и алтернативним начинима терапије. Они би такође требали бити информисани о важности придржавања упутстава о исхрани, редовним физичким активностима, периодичној крви праћење глукозе и А1Ц тестирање, препознавање и лечење хипогликемије и хипергликемије и процена дијабетеса компликације. Током периода стреса као што су грозница, траума, инфекција или операција, захтеви за лековима могу се мењати и пацијенте треба саветовати да одмах потраже лекарску помоћ.
Ризици лактичне ацидозе услед компоненте метформина, њених симптома и стања која предиспонирају њен развој, као што је наведено у Упозорења и мере предострожности, треба објаснити пацијентима. Пацијентима треба саветовати да одмах прекину лијечење Јанумет-ом и да одмах обавијесте свог лијечника у случају необјашњиве хипервентилације, мијалгије, слабост, необична заспаност, вртоглавица, спор или неправилан откуцаји срца, осећај хладноће (нарочито у екстремитетима) или други неспецифични симптоми догодити. Гастроинтестинални симптоми су чести током започињања лечења метформином и могу се јавити током започињања терапије Јануметом; међутим, пацијенти би требало да се консултују са лекаром ако развију необјашњиве симптоме. Иако гастроинтестинални симптоми који се појаве након стабилизације вероватно нису повезани са лековима, такав појава симптома треба проценити да би се утврдило да ли је можда последица лактацидозе или неке друге озбиљне природе болест.
Пацијентима треба саветовати прекомерни унос алкохола, било акутног или хроничног, док примају Јанумет.
Пацијенте треба информисати о важности редовног испитивања бубрежне функције и хематолошких параметара приликом примања лечења Јануметом.
Пацијенте треба обавијестити да су забиљежене алергијске реакције током постмаркетиншке употребе ситаглиптина, једне од компоненти Јанумет-а. Ако се појаве симптоми алергијских реакција (укључујући осип, осип и отеклине на лицу, уснама, језику и грлу настају потешкоће у дисању или гутању), пацијенти морају престати узимати Јанумет и потражити лекарску помоћ одмах.
Лекари треба да упуте својим пацијентима да прочитају Пакет пацијената пре него што започну терапију Јануметом и да га поново прочитају сваки пут када се рецепт обнавља. Пацијенте треба упутити да обавесте свог лекара или фармацеута ако развију било какав необичан симптом или ако се неки познати симптом настави или погорша.
Лабораторијски тестови
Одговор на све дијабетичке терапије треба надгледати периодичним мерењима нивоа глукозе у крви и нивоа А1Ц, са циљем да се ти нивои смање на нормалан опсег. А1Ц је посебно користан за процену дугорочне контроле гликемије.
Почетно и периодично праћење хематолошких параметара (нпр. Хемоглобин / хематоцрит и црвена крв ћелијски индекси) и бубрежну функцију (креатинин у серуму) требало би обављати најмање једном годишње. Док се код терапије метформином ретко виђа мегалобластична анемија, ако се сумња да би требало да се искључи дефицит витамина Б12.
Дистрибуира:
МЕРЦК & ЦО., ИНЦ., Вхитехоусе Статион, Њ 08889, Сједињене Америчке Државе
9794108
УС патент бр.: 6,699,871
1Регистровани заштитни знак компаније МЕРЦК & ЦО., Инц., Вхитехоусе Статион, Нев Јерсеи 08889 УСА
2Традемарк фирме МЕРЦК & ЦО., Инц., Станица Вајтхаус, Њу Џерзи 08889 САД
3ГЛУЦОПХАГЕ® је регистровани заштитни знак Мерцк Санте С.А.С, сарадника Мерцк КГаА из Дармстадта, Немачка.
Дозвољено је компанији Бристол-Миерс Скуибб.
Ауторско право © 2007, 2008 МЕРЦК & ЦО., Инц.
Сва права задржана
Означавање пацијента одобрено од ФДА
Информације о пацијенту
Јанумет® (ЈАН-иоу-мет)
(ситаглиптин / метформин ХЦл)
Таблете
Прочитајте информације о пацијенту које добијате са Јанумет1 пре него што почнете да их узимате и сваки пут када их поново напуните. Можда постоје нове информације. Овај летак не треба да разговара са лекаром о вашем здравственом стању или лечењу.
Које су најважније информације које бих требао знати о Јанумету?
Метформин хидрохлорид, један од састојака у Јанумету, може изазвати ретку, али озбиљну нежељену појаву звану лактацидоза (накупљање млечне киселине у крви) која може проузроковати смрт. Лактацидоза је хитна медицинска помоћ и мора се лечити у болници.
Престаните са узимањем Јанумет-а и одмах позовите лекара ако примите било који од следећих симптома лактацидозе:
- Осећате се врло слабо и уморно.
- Имате необичан (не нормалан) бол у мишићима.
- Имате проблема са дисањем.
- Имате необјашњиве стомачне или цревне проблеме са мучнином и повраћањем или проливом.
- Осећате хладно, нарочито у рукама и ногама.
- Осећате вртоглавицу или несвестицу.
- Имате спор или неправилан пулс.
Имате веће шансе да добијете лактацидозу ако:
- имају бубрежне проблеме.
- имају проблема са јетром.
- имају конгестивну срчану инсуфицијенцију која захтева лечење лековима.
- пијте пуно алкохола (врло често или краткотрајно пиће).
- дехидрирајте се (изгубите велику количину телесне течности). То се може догодити ако сте болесни са врућицом, повраћањем или проливом. Дехидрација се такође може догодити када се пуно знојите са активношћу или вежбањем и не пијете довољно течности.
- имати одређене рендгенске тестове са ињекцијским бојама или контрастним средствима.
- имати операцију.
- имати срчани удар, тешку инфекцију или мождани удар.
- имају 80 или више година и нису тестирали функцију бубрега.
Шта је Јанумет?
Јанумет таблете садрже два лека на рецепт, ситаглиптин (ЈАНУВИА ™ 2) и метформин. Јанумет се може користити заједно са дијетом и вежбањем за снижавање шећера у крви код одраслих пацијената са дијабетесом типа 2. Ваш лекар ће утврдити да ли је Јанумет тачан за вас и утврдиће најбољи начин да започнете и наставите са лечењем дијабетеса.
Јанумет:
- помаже да се побољша ниво инсулина после оброка.
- помаже телу да боље реагује на инсулин који природно производи.
- смањује количину шећера у организму.
- вероватно неће изазвати низак шећер у крви (хипогликемију) када се сам узима за лечење високог шећера у крви.
Јанумет није испитиван код деце млађе од 18 година.
Јанумет није проучаван са инсулином, леком за који се зна да узрокује низак шећер у крви.
Ко не би требало да узме Јанумет?
Не узимајте Јанумет ако:
- имају дијабетес типа 1.
- имају одређене проблеме са бубрезима.
- имати стања која се називају метаболичка ацидоза или дијабетичка кетоацидоза (повећани кетони у крви или урину).
- имали алергијску реакцију на Јанумет или ситаглиптин (ЈАНУВИА), једну од компоненти Јанумет-а.
- примиће ињекцију боје или контрастних средстава за поступак рендгенских зрака, Јанумет ће морати да се заустави на кратко време. Разговарајте са својим лекаром о томе када треба да зауставите Јанумет и када поново треба да започнете. Погледајте "Које су најважније информације које бих требао знати о Јанумету?"
Шта да кажем лекару пре и за време лечења Јануметом?
Јанумет можда није за вас. Обавестите свог лекара о свим својим здравственим стањима, укључујући и ако:
- имају бубрежне проблеме.
- имају проблема са јетром.
- имали алергијску реакцију на Јанумет или ситаглиптин (ЈАНУВИА), једну од компоненти Јанумет-а.
- имају срчане проблеме, укључујући конгестивно затајење срца.
- старији су од 80 година. Пацијенти старији од 80 година не би смели узимати Јанумет уколико се не провери функција бубрега и то је нормално.
- много пијете алкохол (стално или краткотрајно пиће).
- су трудне или планирају да затрудне. Није познато да ли ће Јанумет наштетити вашој нерођеној беби. Ако сте трудни, разговарајте са лекаром о најбољем начину за контролу шећера у крви док сте трудни. Ако Јанумет користите током трудноће, разговарајте са лекаром о томе како можете да будете у регистру Јанумет. Бесплатни телефонски број за евиденцију трудноће је 1-800-986-8999.
- дојите или планирате да дојите. Није познато да ли ће Јанумет ући у мајчино млеко. Разговарајте са лекаром о најбољем начину нахране бебе ако узимате Јанумет.
Обавестите свог лекара о свим лековима које узимате, укључујући лекове на рецепт и на рецепт, витамине и биљне додатке. Јанумет може утицати на учинак других лекова, а неки могу утицати и на то колико Јанумет делује.
Знајте лекове које узимате. Држите листу лекова и покажите је свом лекару и фармацеуту када добијете нови лек. Разговарајте са лекаром пре него што започнете било који нови лек.
Како да примим Јанумет?
- Ваш лекар ће вам рећи колико Јанумет таблета треба да узмете и колико често требате да их узимате. Узмите Јанумет тачно онако како вам је рекао лекар.
- Можда ће ваш лекар морати да повећа дозу за контролу шећера у крви.
- Ваш лекар може да вам пропише Јанумет заједно са сулфонилуреом (други лек за снижавање шећера у крви). Погледајте "Које су могуће нежељене појаве Јанумет-а?" за информације о повећаном ризику од ниског шећера у крви.
- Узмите Јанумет уз оброке да бисте смањили шансу за узнемирени стомак.
- Наставите узимати Јанумет све док вам лекар каже.
- Ако узимате превише Јанумет-а, одмах позовите лекара или центар за контролу отрова.
- Ако пропустите дозу, узмите је с храном чим се сетите. Ако се не сећате док није време за вашу следећу дозу, прескочите пропуштену дозу и вратите се на свој редовни распоред. Не узимајте две дозе Јанумет-а истовремено.
- Можда ћете требати на кратко да престанете да узимате Јанумет. Позовите свог лекара ради упутства ако:
- су дехидрирани (изгубили смо превише телесне течности). Дехидрација се може догодити ако сте болесни са јаким повраћањем, проливом или врућицом или ако пијете пуно мање течности од уобичајене.
- планирајте операцију.
- примиће ињекцију боје или контрастног средства за поступак рендгенских зрака.
Погледајте "Које су најважније информације које бих требао знати о Јанумету?" и "Ко не би требало да узме Јанумет?"
- Када је ваше тело под неким стресом, као што су грозница, траума (попут саобраћајне несреће), инфекције или операције, количина лека за дијабетес која вам је потребна може се променити. Обавестите свог лекара одмах ако имате неко од ових стања и следите упутства лекара.
- Пратите ниво шећера у крви онако како вам каже лекар.
- Држите се прописаног програма исхране и вежби док узимате Јанумет.
- Разговарајте са лекаром о томе како да спречите, препознате и управљате ниским шећером у крви (хипогликемија), високим шећером у крви (хипергликемија) и компликацијама дијабетеса.
- Ваш лекар ће надгледати ваш дијабетес редовним претрагама крви, укључујући ниво шећера у крви и хемоглобин А1Ц.
- Ваш лекар ће урадити крвне претраге како би проверио функцију бубрега пре и током лечења Јануметом.
Које су могуће нежељене појаве Јанумет-а?
Јанумет може изазвати озбиљне нежељене ефекте. Погледајте "Које су најважније информације које бих требао знати о Јанумету?"
Уобичајене нежељене појаве приликом узимања Јанумет-а укључују:
- зачепљен или цури нос и грлобоља
- горњег респираторног инфекција
- пролив
- мучнина и повраћање
- гас, нелагода у стомаку, пробавне сметње
- слабост
- главобоља
Узимање Јанумет-а уз оброке може помоћи у смањењу уобичајених нежељених ефеката метформина које се обично јављају на почетку лечења. Ако имате необичне или неочекиване стомачне тегобе, разговарајте са лекаром. Проблеми са стомаком који се покрену касније током лечења могу бити знак нечег озбиљнијег.
Одређени лекови против дијабетеса, попут сулфонилурее и меглитинида, могу изазвати низак шећер у крви (хипогликемију). Када се Јанумет користи са овим лековима, можда ћете имати шећера у крви који су прениски. Ваш лекар може да вам пропише ниже дозе лека сулфонилурее или меглитинида. Обавестите свог лекара ако имате проблема са ниским шећером у крви.
Следеће додатне нуспојаве су забележене у општој употреби са Јануметом или ситаглиптином:
- Озбиљне алергијске реакције могу се десити са Јануметом или ситаглиптином, једним од лекова у Јанумету. Симптоми озбиљне алергијске реакције могу укључивати осип, осип и отеклине на лицу, уснама, језику и грлу, отежано дисање или гутање. Ако имате алергијску реакцију, престаните са узимањем Јанумет-а и одмах позовите лекара. Ваш лекар може да вам пропише лек за лечење алергијске реакције и различите лекове за дијабетес.
- Повишени јетрени ензими.
- Упала панкреаса.
Ово нису све могуће нежељене дејства Јанумет-а. За више информација обратите се свом лекару.
Реците свом лекару ако имате било који нежељени ефекат који вас мучи, је неуобичајен или не нестаје.
Како да чувам Јанумет?
Чувајте Јанумет на собној температури, 20-25 ° Ц, 68-77 ° Ф.
Држите Јанумет и све лекове ван дохвата деце.
Опште информације о употреби Јанумет-а
Лекови се понекад прописују код стања која нису наведена у брошурама са пацијентима. Не користите Јанумет за стање за које није прописано. Немојте давати Јанумет другим људима, чак и ако имају исте симптоме као и ви. Може им наштетити.
Овај летак сажима најважније информације о Јанумету. Ако желите да сазнате више информација, разговарајте са лекаром. Можете питати свог лекара или фармацеута за информације о Јанумету који су написани за здравствене раднике. За више информација позовите 1-800-622-4477.
Који су састојци у Јанумету?
Активни састојци: ситаглиптин и метформин хидрохлорид.
Неактивни састојци: микрокристална целулоза, поливинилпиролидон, натријум лаурил сулфат и натријум стеарил фумарат. Превлака фолије за таблете садржи следеће неактивне састојке: поливинил алкохол, полиетилен гликол, талк, титанијум диоксид, црвени гвожђе оксид и црни гвожђе оксид.
Шта је дијабетес типа 2?
Дијабетес типа 2 је стање у којем ваше тело не ствара довољно инзулина, а инзулин који ваше тијело производи не дјелује онако како би требао. Ваше тело може да направи превише шећера. Када се то догоди, шећер (глукоза) се накупља у крви. Ово може довести до озбиљних медицинских проблема.
Главни циљ лечења дијабетеса је снизити шећер у крви на нормалан ниво. Снижавање и контрола шећера у крви може помоћи у спречавању или одгађању компликација дијабетеса, попут проблема са срцем, бубрежним проблемима, слепила и ампутације.
Високи шећер у крви се може снизити дијетом и вежбањем, те неким лековима када је неопходно.
Издато марта 2009
Дистрибуира:
МЕРЦК & ЦО., ИНЦ., Вхитехоусе Статион, Њ 08889, Сједињене Америчке Државе
Последње ажурирано: 03.09
Јанумет, Ситаглиптин и Метформин хидрохлорид, информације о пацијенту (на обичном енглеском)
Детаљне информације о знаковима, симптомима, узроцима, лечењу дијабетеса
Информације у овој монографији нису намијењене покривању свих могућих употреба, упута, мјера опреза, интеракције лијекова или штетних учинака. Ове информације су уопштене и нису замишљене као посебни медицински савети. Ако имате питања о лековима које узимате или желите више информација, обратите се свом лекару, фармацеуту или медицинској сестри.
назад на: Прегледајте све лекове за дијабетес



