Авандиа за лечење дијабетеса
Робна марка: АВАНДИА
Генеричко име: росиглитазон малеат
Садржај:
Индикације и употреба
Дозирање и администрација
Облици дозирања и дозирање
Контраиндикације
Упозорења и мере предострожности
Нежељене реакције
Интеракције са лековима
Употреба у одређеној популацији
Предозирање
Опис
Клиничка фармакологија
Неклиничка токсикологија
Клиничке студије
Како се испоручује
Авандиа, росиглитазон малеат, информације о пацијенту (на обичном енглеском)
УПОЗОРЕЊЕ
КОНГЕСТИВНА СЛОБОДА СРЦЕ И МИОЦАРДИЈАЛНА ИСХЕМИЈА
- Тиазолидиндиони, укључујући росиглитазон, код неких пацијената изазивају или погоршавају конгестивну срчану инсуфицијенцију [видети УПОЗОРЕЊА И УПОЗОРЕЊЕ]. Након покретања АВАНДИА-е и након повећања дозе, пажљиво посматрајте пацијенте због знакова и симптома срчане инсуфицијенције (укључујући прекомерно, брзо дебљање, диспнеју и / или едеме). Ако се ови знакови и симптоми развију, затајење срца треба управљати у складу са тренутним стандардима неге. Надаље, мора се размотрити прекид или смањење дозе АВАНДИА.
- АВАНДИА се не препоручује пацијентима са симптоматском срчаном инсуфицијенцијом. Иницирање АВАНДИА код пацијената са утврђеном срчаном инсуфицијенцијом НИХА класе ИИИ или ИВ је контраиндицирано. [Види КОНТРАИНДИКАЦИЈЕ и УПОЗОРЕЊА И УПОЗОРЕЊЕ.]
- Мета-анализа 42 клиничке студије (средње трајање 6 месеци; 14.237 укупно пацијената), од којих је већина упоређивала АВАНДИА са плацебом, показало је да АВАНДИА повезује са повећаним ризиком од исхемијских догађаја миокарда као што су ангина или инфаркт миокарда. Три друге студије (средње трајање 41 месец; 14.067 укупно пацијената), упоређујући АВАНДИА са неким другим одобреним оралним антидијабетичким лековима или плацебом, нису потврдили или искључили овај ризик. Доступни подаци о ризику од исхемије миокарда су у целости непоуздани. [Види УПОЗОРЕЊА И УПОЗОРЕЊЕ.]
врх
Индикације и употреба
Монотерапија и комбинована терапија
АВАНДИА је индициран као додатак исхрани и вежбању ради побољшања контроле гликемије код одраслих са шећерном болешћу типа 2.
Важна ограничења употребе
- Због свог механизма деловања, АВАНДИА је активан само у присуству ендогеног инсулина. Стога се АВАНДИА не сме користити код пацијената са дијабетесом мелитусом типа 1 или за лечење дијабетичке кетоацидозе.
- Не препоручује се истодобна примена АВАНДИА и инсулина.
- Употреба АВАНДИА са нитратима се не препоручује.
врх
Дозирање и администрација
Управљање антидијабетичком терапијом треба индивидуализовати. Сви пацијенти би требало да започну АВАНДИА у најнижој препорученој дози. Даљње повећање дозе АВАНДИА мора бити праћено пажљивим надгледањем нежељених догађаја повезаних са задржавањем течности [видети Бокед Варнинг и УПОЗОРЕЊА и мере предострожности].
АВАНДИА се може давати у почетној дози од 4 мг било као једна дневна доза, или у 2 подељене дозе. За пацијенте који неадекватно реагују након лечења од 8 до 12 недеља, што је одређено смањењем глукозе у плазми на тесту (ФПГ), доза се може повећати на 8 мг дневно као монотерапија или у комбинацији са метформином, сулфонилурејом или сулфонилурејом плус метформин. Смањење гликемијских параметара по дози и режиму описано је у Клиничким студијама. АВАНДИА се може узимати са или без хране.
Укупна дневна доза АВАНДИА не сме да пређе 8 мг.
Монотерапија
Уобичајена почетна доза АВАНДИА је 4 мг која се даје или као појединачна доза једном дневно, или у подељеним дозама два пута дневно. У клиничким испитивањима, режим од 4 мг два пута дневно резултирао је највећим смањењем ФПГ и хемоглобина А1ц (ХбА1ц).
Комбинација са сулфонилуреом или метформином
Када се АВАНДИА дода постојећој терапији, тренутна (е) доза (и) агенса (а) може се наставити након започињања терапије са АВАНДИА.
Сулфонилуреа: Када се користи у комбинацији са сулфонилурејом, уобичајена почетна доза АВАНДИА је 4 мг, која се даје као појединачна доза једном дневно или у подељеним дозама два пута дневно. Ако пацијенти извештавају о хипогликемији, дозу сулфонилуреје треба смањити.
Метформин: Уобичајена почетна доза АВАНДИА у комбинацији са метформином је 4 мг која се даје као појединачна доза једном дневно или у подељеним дозама два пута дневно. Мало је вероватно да ће доза метформина захтевати прилагођавање због хипогликемије током комбиноване терапије АВАНДИА-ом.
Комбинација са Сулфонилуреа Плус Метформином
Уобичајена почетна доза АВАНДИА у комбинацији са сулфонилурејом плус метформином је 4 мг која се даје у виду једне дозе једном дневно или подељене дозе два пута дневно. Ако пацијенти извештавају о хипогликемији, дозу сулфонилуреје треба смањити.
Специфична популација пацијената
Оштећење бубрега: Није потребно прилагођавање дозе ако се АВАНДИА користи као монотерапија код пацијената са оштећењем бубрега. Пошто је метформин контраиндициран код таквих болесника, истодобна примена метформина и АВАНДИА такође је контраиндицирана код пацијената са оштећењем бубрега.
Оштећење јетре: Пре почетка лечења АВАНДИА-ом, требало би измерити јетрене ензиме. Терапија АВАНДИА-ом не треба започети ако пацијент покаже клиничке доказе о активности болест јетре или повећани ниво трансаминазе у серуму (АЛТ> 2.5Кс горња граница нормале на почетку терапија). Након покретања АВАНДИА, јетрене ензиме треба периодично надгледати према клиничкој процени здравственог радника. [Види УПОЗОРЕЊА и мере предострожности и КЛИНИЧКА ФАРМАКОЛОГИЈА.]
Педијатријски: Подаци нису довољни да препоручују педијатријску употребу АВАНДИА [види УПОТРЕБА У ПОСЕБНИМ ПОПУЛАЦИЈАМА].
врх
Облици дозирања и снаге
Пентагонална филмом обложена таблета ТИЛТАБ садржи росиглитазон као малеат, како следи:
- 2 мг - ружичасте боје, утиснуте са СБ на једној страни и 2 на другој страни
- 4 мг - наранџасте, утиснуто са СБ на једној страни и 4 на другој страни
- 8 мг - црвено-браон, утиснут са СБ са једне стране и 8 са друге
врх
Контраиндикације
Започињање АВАНДИА-е код пацијената са утврђеном срчаном инсуфицијенцијом Њујоршког срца (НИХА) класе ИИИ или ИВ класе је контраиндицирано [видети БОКСЕД УПОЗОРЕЊЕ].
врх
Упозорења и мере предострожности
Срчани застој
АВАНДИА, као и други тиазолидиндиони, сама или у комбинацији са другим антидијабетичким агенсима, може изазвати задржавање течности, што може погоршати или довести до затајења срца. Пацијенте треба посматрати због знакова и симптома срчане инсуфицијенције. Ако се ови знакови и симптоми развију, затајење срца треба управљати у складу са тренутним стандардима неге. Надаље, мора се размотрити прекид или смањење дозе росиглитазона [види БОКСЕД УПОЗОРЕЊЕ].
Пацијенти са конгестивном срчаном инсуфицијенцијом (ЦХФ) НИХА класе И и ИИ лечени АВАНДИА-ом имају повећан ризик од кардиоваскуларних догађаја. Извршено је двонедељно двоструко слепо, плацебо контролирано ехокардиографско истраживање на 224 пацијента са типом 2 дијабетес мелитус и НИХА класе И или ИИ ЦХФ (фракција избацивања ¤ ¤ 45%) на антидијабетику и ЦХФ терапија. Независни одбор спровео је слепу процену догађаја повезаних са течношћу (укључујући конгестивно затајење срца) и кардиоваскуларне хоспитализације према унапред дефинисаним критеријумима (пресуда). Истражитељи су, одвојено од пресуде, пријавили и друге кардиоваскуларне штетне догађаје. Иако није примећена разлика у лечењу у променама од почетне фракције избацивања, више примећени су кардиоваскуларни нежељени догађаји након лечења АВАНДИА-ом у поређењу са плацебом током 52-недељно истраживање. (Види табелу 1.)
Табела 1. Хитни кардиоваскуларни нежељени догађаји код пацијената са застојним срчаним затајењем (НИХА класе И и ИИ) лечених АВАНДИА-ом или плацебом (уз додатак терапији антидијабетичара и ЦХФ-а)
| Догађаји | АВАНДИА Н = 110 н (%) |
Плацебо Н = 114 н (%) |
| Предодређено | ||
| Кардиоваскуларне смрти | 5 (5%) | 4 (4%) |
| Погоршање ЦХФ | 7 (6%) | 4 (4%) |
| - са преконоћном хоспитализацијом | 5 (5%) | 4 (4%) |
| - без хоспитализације преко ноћи | 2 (2%) | 0 (0%) |
| Нови или погоршавајући едеми | 28 (25%) | 10 (9%) |
| Нова или погоршавајућа диспнеја | 29 (26%) | 19 (17%) |
| Повећање лекова са ЦХФ | 36 (33%) | 20 (18%) |
| Кардиоваскуларна хоспитализација * | 21 (19%) | 15 (13%) |
| Извештава истражитељ, није донесена пресуда | ||
| Исхемијски нежељени догађаји | 10 (9%) | 5 (4%) |
| - Инфаркт миокарда | 5 (5%) | 2 (2%) |
| - Ангина | 6 (5%) | 3 (3%) |
| * Укључује хоспитализацију из било којег кардиоваскуларног разлога. |
Иницирање АВАНДИА код пацијената са утврђеном срчаном инсуфицијенцијом НИХА класе ИИИ или ИВ је контраиндицирано. АВАНДИА се не препоручује пацијентима са симптоматском срчаном инсуфицијенцијом. [Види БОКСЕД УПОЗОРЕЊЕ.]
Пацијенти који су имали акутне коронарне синдроме нису проучавани у контролисаним клиничким испитивањима. С обзиром на потенцијал за развој срчане инсуфицијенције код пацијената са акутним коронарним догађајем, почетак АВАНДИА није препоручује се пацијентима који су доживели акутни коронарни догађај и треба прекинути узимање лека АВАНДИА током ове акутне фазе разматрати.
Пацијенти са срчаним статусом НИХА класе ИИИ и ИВ (са или без ЦХФ) нису испитивани у контролисаним клиничким испитивањима. АВАНДИА се не препоручује пацијентима са срчаним статусом НИХА класе ИИИ и ИВ.
Исхемија миокарда
Метаанализа исхемије миокарда у групи од 42 клиничка испитивања
Ретроспективно је извршена метаанализа како би се проценили кардиоваскуларни нежељени догађаји пријављени током 42 двоструко слепа, рандомизована, контролисана клиничка испитивања (средње трајање 6 месеци).1
Ове студије су проведене како би се процијенила ефикасност снижавања глукозе код дијабетеса типа 2, а проспективно планирано пресуђивање кардиоваскуларних догађаја није дошло у испитивањима. Нека испитивања су била плацебо-контролисана, а нека су користила активне оралне антидијабетичке лекове као контролу. Плацебо-контролиране студије су укључивале испитивања монотерапије (монотерапија АВАНДИА-ом насупрот плацебо-монотерапији) и додатна испитивања (АВАНДИА или плацебо, додата сулфонилуреи, метформину или инсулину). Активне контролне студије укључивале су испитивања монотерапије (монотерапија АВАНДИА-ом насупрот сулфонилуреи или метформину монотерапија) и додатна испитивања (АВАНДИА плус сулфонилуреа или АВАНДИА плус метформин, насупрот сулфонилуреи плус метформин). Укупно је укључено 14.237 пацијената (8.604 у групама за лечење које су садржале АВАНДИА, 5.633 инча упоредне групе), са 4.143 пацијентских година изложености АВАНДИА и 2.675 пацијентских година изложености упоређивач. Исхемијски догађаји миокарда укључују ангину пекторис, погоршану ангину, нестабилну ангину, застој срца, бол у грудима, коронарну оклузија артерија, диспнеја, инфаркт миокарда, коронарна тромбоза, исхемија миокарда, коронарна болест и коронарна артерија поремећај. У овој анализи, повећан ризик од миокардијалне исхемије са АВАНДИА наспрам здружених компаратора примећено је (2% АВАНДИА према 1,5% компаратора, омјер коефицијента 1,4, интервал поузданости 95% [ЦИ] 1,1, 1.8). Повећани ризик од исхемијских догађаја миокарда код АВАНДИА примећен је у плацебо контролисаним студијама, али не и у активно контролисаним студијама. (Погледајте слику 1.)
Већи повећани ризик од исхемијских догађаја миокарда примећен је у студијама у које је додата АВАНДИА на инзулин (2,8% за АВАНДИА плус инзулин у односу на 1,4% за плацебо плус инсулин, [ИЛИ 2,1, 95% ЦИ 0,9, 5.1]). Овај повећани ризик одражава разлику од 3 догађаја на 100 пацијентских година (95% ЦИ -0,1, 6,3) између група лечења. [Види УПОЗОРЕЊА И УПОЗОРЕЊЕ.]
Слика 1. Коефицијенти шума (95% интервала интервала) за исхемијске догађаје миокарда у метаанализи 42 клиничка испитивања

Већи повећани ризик од исхемије миокарда примећен је и код пацијената који су примали АВАНДИА и терапију позадинским нитратима. За АВАНДИА (Н = 361) наспрам контроле (Н = 244) код корисника нитрата, омјер коефицијента био је 2,9 (95% ЦИ 1,4, 5,9), док је за кориснике који нису нитрати (укупно око 14 000 пацијената) коефицијент квоте био 1,3 (95% ЦИ 0,9, 1.7). Овај повећани ризик представља разлику од 12 исхемијских догађаја миокарда на 100 пацијентских година (95% ИЗ 3.3, 21.4). Већина корисника нитрата имала је коронарну болест срца. Међу пацијентима с познатом срчаном болешћу који нису били на нитратној терапији, није показан повећани ризик од миокардијалне исхемијске појаве за АВАНДИА у односу на упоређивач.
Исхемијски догађаји миокарда у великим дугорочним перспективним насумичним контролисаним испитивањима компаније АВАНДИА
Подаци из 3 друга велика, дугорочна, перспективна, рандомизована, контролисана клиничка испитивања АВАНДИА процењени су одвојено од метаанализе. Ова три испитивања укључују укупно 14 067 пацијената (групе за лечење које садрже АВАНДИА Н = 6.311, компаратер групе Н = 7,756), са изложеношћу од 21 803 пацијентских година за АВАНДИА и 25,998 пацијентских година за упоређивач. Трајање праћења је у свакој студији премашило 3 године. АДОПТ (Испитивање исхода исхода дијабетеса) је 4-6-годишње рандомизовано, активно контролисано истраживање код недавно дијагностикованих пацијената са дијабетесом типа 2 на терапији лековима.
Испитивање ефикасности и опште сигурности дизајнирано је тако да испита трајност
АВАНДИА као монотерапија (Н = 1,456) за контролу гликемије код дијабетеса типа 2, са компаративним групама монотерапије сулфонилурејом (Н = 1,441) и монотерапијом метформином (Н = 1,454). ДРЕАМ (Процена смањења дијабетеса са Росиглитазоном и леком Рамиприл, објављен извештај2) била је 3- до Петогодишња рандомизирана, плацебо-контролирана студија код пацијената с оштећеном глукозном толеранцијом и / или оштећеним постом глукоза Имао је 2к2 факторски дизајн намењен процени утицаја АВАНДИА, а одвојено и од рамиприла (инхибитора ангиотензинског претварајућег ензима [АЦЕИ]), на прогресију ка очигледном дијабетесу. У ДРЕАМ-у, 2.635 пацијената било је у групама за лечење које су садржале АВАНДИА, а 2.634 у групама за лечење које не садрже АВАНДИА.Интерим резултати објављени су 3 за РЕЦОРД (Росиглитазон процењен на кардијалне исходе и регулацију гликемије у Дијабетес), непрекидна 6-годишња студија о кардиоваскуларним исходима код пацијената са дијабетесом типа 2 са просечним лечењем трајање 3,75 година. РЕЦОРД укључује пацијенте који нису успели са монотерапијом метформином или сулфонилурејом; они који нису успели са метформином насумично се примају или додатак АВАНДИА или додатни сулфонилуреа, а они који нису успели са сулфонилурејом насумично су примљени или АВАНДИА или додатак метформин. У РЕЦОРД-у, укупно 2.220 пацијената прима додатке АВАНДИА, а 2.227 пацијената је на једном од режима за додавање који не садрже АВАНДИА.
За ова три испитивања, анализе су рађене коришћењем композита главних штетних кардиоваскуларних догађаја (инфаркт миокарда, кардиоваскуларна смрт или мождани удар), у даљем тексту МАЦЕ. Ова крајња тачка разликовала се од широке крајње тачке метаанализе миокардијалних исхемијских догађаја, од којих је више од половине била ангина. Инфаркт миокарда укључио је судски фатални и нефатални инфаркт миокарда плус изненадну смрт. Као што је приказано на слици 2, резултати за 3 крајње тачке (МАЦЕ, МИ и укупни морталитет) нису се статистички значајно разликовали између АВАНДИА и компаратора.

У прелиминарним анализама испитивања ДРЕАМ учесталост кардиоваскуларних догађаја била је већа међу испитаницима који су примали су АВАНДИА у комбинацији са рамиприлом него међу испитаницима који су примали сам рамиприл, као што је илустровано у Слика 2. Овај налаз није потврђен у АДОПТ и РЕЦОРД (активно контролисана испитивања на пацијентима са дијабетесом) код којих је 30% и 40% пацијената, по почетној основи, пријавило употребу АЦЕ инхибитора.
Доступни подаци о ризику од исхемије миокарда су у целости непоуздани. Дефинитивни закључци у вези с овим ризиком очекују завршетак адекватно дизајниране студије о кардиоваскуларном исходу.
Није било клиничких студија које би утврдиле коначне доказе о смањењу макроваскуларног ризика с АВАНДИА или било којим другим оралним антидијабетичким леком.
Конгестивно затајивање срца и миокардијална исхемија током истодобне примене АВАНДИА са инсулином
У студијама у којима је АВАНДИА додат инзулин, АВАНДИА повећава ризик од конгестивног затајења срца и исхемије миокарда. (Види табелу 2.)
Не препоручује се примена АВАНДИА и инсулина. [Види Индикације и употреба и УПОЗОРЕЊА И УПОЗОРЕЊЕ.]
У пет, 26-недељних, контролисаних, рандомизованих, двоструко слепих испитивања која су укључена у метаанализу [видети УПОЗОРЕЊА И УПОЗОРЕЊЕ], болесници са дијабетесом мелитуса типа 2 рандомизирани су у истодобну примену АВАНДИА и инсулина (Н = 867) или инсулина (Н = 663). У ових 5 испитивања АВАНДИА је додата инсулину. Ова испитивања су укључивала пацијенте са дугогодишњом дијабетесом (средњо трајање од 12 година) и великом преваленцијом већ постојећег медицинска стања, укључујући периферну неуропатију, ретинопатију, исхемијску болест срца, васкуларне болести и конгестивно срце неуспех. Укупан број пацијената са хитном конгестивном срчаном инсуфицијенцијом био је 21 (2,4%) и 7 (1,1%) у АВАНДИА плус инсулину и инсулинској групи, респективно. Укупан број пацијената са насталом исхемијом миокарда био је 24 (2,8%) и 9 (1,4%) у АВАНДИА плус инсулину и инзулинским групама, односно (ОР 2,1 [95% ЦИ 0,9, 5,1]). Иако је стопа проучавања конгестивне срчане инсуфицијенције и исхемије миокарда била ниска у проучаваној број становника, доследно, стопа догађаја је била двострука или виша, уз заједничку администрацију АВАНДИА и инсулин. Ови кардиоваскуларни догађаји примећени су и код дневних доза од 4 мг и 8 мг АВАНДИА. (Види табелу 2.)
Табела 2. Појава кардиоваскуларних догађаја у 5 контролисаних испитивања додавања АВАНДИА у устаљено лечење инзулином
| Евент * | АВАНДИА + Инсулин (н = 867) н (%) |
Инсулин (н = 663) н (%) |
| Конгестивна срчана инсуфицијенција | 21 (2.4%) | 7 (1.1%) |
| Исхемија миокарда | 24 (2.8%) | 9 (1.4%) |
| Састав је кардиоваскуларне смрти, инфаркта миокарда или можданог удара | 10 (1.2%) | 5 (0.8%) |
| Удар | 5 (0.6%) | 4 (0.6%) |
| Инфаркт миокарда | 4 (0.5%) | 1 (0.2%) |
| Кардиоваскуларна смрт | 4 (0.5%) | 1 (0.2%) |
| Све смрти | 6 (0.7%) | 1 (0.2%) |
| * Догађаји нису ексклузивни; тј. пацијент са кардиоваскуларном смрћу услед инфаркта миокарда бројиће се у 4 категорије догађаја (исхемија миокарда; кардиоваскуларна смрт, инфаркт миокарда или мождани удар; инфаркт миокарда; кардиоваскуларна смрт). |
У шестом, 24-недељном, контролисаном, рандомизованом, двоструко слепом испитивању АВАНДИА и истодобној примени инсулина, инсулин је додат АВАНДАМЕТ® (росиглитазон малеат и метформин ХЦл) (н = 161) и у поређењу са инсулином плус плацебом (н = 158), након једнонедељног пробе од 8 недеља са АВАНДАМЕТ Пацијенти са едемима који захтевају фармаколошку терапију и они са конгестивном срчаном инсуфицијенцијом искључени су у почетној фази и током периода у коме су се јављали.
У групи која је примала АВАНДАМЕТ плус инзулин био је један исхемијски догађај миокарда и једна изненадна смрт. У групи са инсулином није примећена исхемија миокарда, а ни у једној групи није примећено конгестивно затајење срца.
Едема
АВАНДИА треба примењивати с опрезом код пацијената са едемом. У клиничкој студији на здравим добровољцима који су примали 8 мг АВАНДИА једном дневно током 8 недеља, дошло је до статистички значајног повећања просечне запремине плазме у односу на плацебо.
Будући да тиазолидиндиони, укључујући росиглитазон, могу изазвати задржавање течности, што може погоршати или доводе до конгестивне срчане инсуфицијенције, АВАНДИА треба примењивати с опрезом код пацијената који ризикују настанак срца неуспех. Пацијенте треба надгледати због знакова и симптома срчане инсуфицијенције [види БОКСЕД УПОЗОРЕЊЕ, УПОЗОРЕЊА И УПОЗОРЕЊЕ ].
У контролираним клиничким испитивањима пацијената са дијабетесом типа 2, пријављен је благи до умјерени едем код пацијената лијечених АВАНДИА-ом и могу бити повезани са дозом. Пацијенти са текућим едемом имали су већу вероватноћу да ће имати нежељене догађаје повезане са едемом ако су започели са комбинованом терапијом инсулином и АВАНДИА [видети НЕЖЕЉЕНЕ РЕАКЦИЈЕ].
Добијање на тежини
Дозирање везано за дозу уочено је само уз АВАНДИА и у комбинацији са другим хипогликемијским агенсима (Табела 3). Механизам дебљања је нејасан, али вероватно укључује комбинацију задржавања течности и накупљања масти.
У искуству постмаркетинга, појавили су се извештаји о неуобичајено брзом повећању тежине и повећању веће од оног који се обично примећује у клиничким испитивањима. Пацијенте који доживе таква повећања треба проценити на нагомилавање течности и догађаје повезане са количином, попут прекомерног едема и конгестивне срчане инсуфицијенције [видети БОКСЕД УПОЗОРЕЊЕ].
Табела 3. Промене тежине (кг) од основне линије на крајњој точки током клиничких испитивања
| Монотерапија | Трајање | Контролна група | АВАНДИА 4 мг Медијан (25., 75 пертилетил) |
АВАНДИА 8 мг Медијан (25., 75 пертилетил) |
|
| Медијан (25., 75 пертилетил) | |||||
| 26 недеља | плацебо | -0.9 (-2.8, 0.9) н = 210 |
1.0 (-0.9, 3.6) н = 436 |
3.1 (1.1, 5.8) н = 439 |
|
| 52 недеље | сулфонилуреа | 2.0 (0, 4.0) н = 173 |
2.0 (-0.6, 4.0) н = 150 |
2.6 (0, 5.3) н = 157 |
|
| Комбинована терапија | |||||
| Сулфонилуреа | 24-26 недеља | сулфонилуреа | 0 (-1.0, 1.3) н = 1,155 |
2.2 (0.5, 4.0) н = 613 |
3.5 (1.4, 5.9) н = 841 |
| Метформин | 26 недеља | метформин | -1.4 (-3.2, 0.2) н = 175 |
0.8 (-1.0, 2.6) н = 100 |
2.1 (0, 4.3) н = 184 |
| Инсулин | 26 недеља | инсулин | 0.9 (-0.5, 2.7) н = 162 |
4.1 (1.4, 6.3) н = 164 |
5.4 (3.4, 7.3) н = 150 |
| Сулфонилуреа + метформин | 26 недеља | сулфонилуреа + метформин | 0.2 (-1.2, 1.6) н = 272 |
2.5 (0.8, 4.6) н = 275 |
4.5 (2.4, 7.3) н = 276 |
У 4- до 6 година, монотерапија, компаративно испитивање (АДОПТ) код пацијената недавно дијагностикованих дијабетеса типа 2, који претходно нису лечени антидијабетичким лековима [видети Цлиницал Студиес], средња промена тежине (25тх, 75тх у постотцима) од почетне вриједности за 4 године је било 3,5 кг (0,0, 8,1) за АВАНДИА, 2,0 кг (-1,0, 4,8) за глибурид и -2,4 кг (-5,4, 0,5) за метформин.
У истраживању од 24 недеље на педијатријским пацијентима узраста од 10 до 17 година лечених АВАНДИА 4 до 8 мг дневно, средњи просечни добитак телесне тежине од 2,8 кг (25тх, 75тх пријављени су постотци: 0,0, 5,8).
Хепатички ефекти
Јетрене ензиме требало би измерити пре започињања терапије АВАНДИА-ом код свих пацијената и периодично након тога, према клиничкој процени здравственог радника. Терапија АВАНДИА-ом не треба започети код пацијената са повишеним основним нивоима јетрених ензима (АЛТ> 2,5Кс горња граница нормале). Пацијенти са благо повишеним јетреним ензимима (ниво АЛТ-а 2,5 Кс горња граница нормале) од почетног или током терапије АВАНДИА-ом треба проценити да би се утврдио узрок јетрених ензима надморска висина. Започињање или наставак терапије АВАНДИА-ом код пацијената са благим порастом ензима у јетри требало би да се настави опрезно и укључују помно клиничко праћење, укључујући праћење јетрених ензима како би се утврдило да ли је повишење јетрених ензима разрешило или погоршати. Ако у било којем тренутку ниво АЛТ порасте на> 3Кс горњу границу нормале код пацијената на терапији АВАНДИА-ом, ниво јетрених ензима треба што пре испитати. Ако ниво АЛТ остане> 3Кс горња граница нормале, терапију АВАНДИА-ом треба прекинути.
Ако било који пацијент развије симптоме који сугеришу јетрену дисфункцију, што може укључивати необјашњиву мучнину, повраћање, бол у трбуху, умор, анорексију и / или таман урин, треба провјерити јетрене ензиме. Одлука о томе да ли да настави пацијента на терапији АВАНДИА-ом требало би да се заснива на клиничкој процени до лабораторијске процене. Ако се примети жутица, терапију лековима треба прекинути. [Види НЕЖЕЉЕНЕ РЕАКЦИЈЕ.]
Макуларни едем
Забиљежен је макуларни едем у постмаркетиншком искуству код неких дијабетичара који су узимали АВАНДИА или неки други тиазолидиндион. Неки пацијенти су имали замагљен вид или смањену оштрину вида, али чини се да су неки пацијенти дијагностицирани на рутинском офталмолошком прегледу. Већина пацијената имала је периферни едем у време када је дијагностикован макуларни едем. Неки пацијенти су имали побољшање свог макуларног едема након престанка узимања тиазолидиндиона. Пацијенти са дијабетесом требали би имати редовне прегледе ока код офталмолога, према стандардима неге Америчке асоцијације за дијабетес. Уз то, сваки дијабетичар који пријави било који вид визуелних симптома треба одмах да буде упућен офталмологу, без обзира на пацијентове лекове или друге физичке налазе. [Види НЕЖЕЉЕНЕ РЕАКЦИЈЕ.]
Преломи
У 4- до 6-годишњем компаративном истраживању (АДОПТ) контроле гликемије монотерапијом код пацијената који лече на лековима недавно дијагностициран дијабетес мелитус типа 2, примећена је повећана учесталост прелома костију код пацијената који су узимали АВАНДИА. Током периода од 4-6 година, учесталост прелома костију код жена била је 9,3% (60/645) за АВАНДИА, у поређењу са 3,5% (21/605) за глибурид и 5,1% (30/590) за метформин. Ова повећана учесталост примећена је после прве године лечења и наставила се током студије. Већина прелома код жена које су примиле АВАНДИА догодила се у надлактици, руци и стопалу. Ова места прелома разликују се од оних која су обично повезана са постменопаузалном остеопорозом (нпр. Кук или кичма). Није примећено повећање стопе прелома код мушкараца лечених АВАНДИА-ом. Ризик од прелома треба размотрити код неге пацијената, посебно жена које се лече АВАНДИА, и пажња која се посвећује процени и одржавању здравља костију у складу са тренутним стандардима нега.
Хематолошки ефекти
Пад просјечног хемоглобина и хематокрита настао је на начин повезан с дозом код одраслих пацијената лијечених АВАНДИА [види НЕЖЕЉЕНЕ РЕАКЦИЈЕ]. Примећене промене могу бити повезане са повећаном запремином плазме која је примећена лечењем АВАНДИА.
Контрола дијабетеса и глукозе у крви
Пацијенти који примају АВАНДИА у комбинацији са другим хипогликемијским агенсима могу бити изложени ризику од хипогликемије, па ће можда бити потребно и смањење дозе истодобног средства.
Потребно је извршити периодична мерења глукозе у крви и ХбА1ц како би се пратио терапијски одговор.
Овулација
Терапија АВАНДИА-ом, као и други тиазолидиндиони, може резултирати овулацијом код неких пременопаузалних ановулаторних жена. Као резултат, ове пацијенткиње могу имати повећан ризик за трудноћу док узимају АВАНДИА [видети Употреба у одређеној популацији]. Стога би требало препоручити адекватну контрацепцију код жена у пременопаузи. Овај могући ефекат није посебно истражен у клиничким студијама; према томе, учесталост ове појаве није позната.
Иако је у предклиничким студијама примећена хормонска неравнотежа [види Неклиничка токсикологија], клинички значај овог налаза није познат. Ако се догоди неочекивана менструална дисфункција, треба преиспитати предности настављене терапије АВАНДИА-ом.
врх
Нежељене реакције
Клиничко суђење
Одрасли
У клиничким испитивањима, око 9.900 пацијената са дијабетесом типа 2 лечено је АВАНДИА-ом.
Краткотрајна испитивања АВАНДИА као монотерапије и у комбинацији са другим хипогликемијским агенсима
Учесталост и врсте нежељених догађаја пријављених у краткотрајним клиничким испитивањима АВАНДИА као монотерапије приказани су у Табели 4.
Табела 4. Нежељени догађаји (‰ ¥ 5% у било којој групи за лечење) које су пријавили пацијенти у краткорочном * двоструко слепом клиничком испитивању са АВАНДИА као монотерапијом
| Преферред Терм | АВАНДИА Монотерапија Н = 2,526 % |
Плацебо Н = 601 % |
Метформин Н = 225 % |
Сулфонилуреаса € Н = 626 % |
| Инфекције горњих дисајних путева | 9.9 | 8.7 | 8.9 | 7.3 |
| Повреда | 7.6 | 4.3 | 7.6 | 6.1 |
| Главобоља | 5.9 | 5.0 | 8.9 | 5.4 |
| Бол у леђима | 4.0 | 3.8 | 4.0 | 5.0 |
| Хипергликемија | 3.9 | 5.7 | 4.4 | 8.1 |
| Умор | 3.6 | 5.0 | 4.0 | 1.9 |
| Синуситис | 3.2 | 4.5 | 5.3 | 3.0 |
| Пролив | 2.3 | 3.3 | 15.6 | 3.0 |
| Хипогликемија | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Краткотрајна испитивања кретала су се у распону од 8 недеља до једне године. †Укључује пацијенте који примају глибурид (Н = 514), гликлазид (Н = 91) или глипизид (Н = 21). |
Све у свему, врсте нежељених реакција без обзира на узрочно-посљедичне везе пријављене су када је коришћен АВАНДИА у комбинацији са сулфонилуреом или метформином били су слични онима током монотерапије са АВАНДИА.
Догађаји анемије и едема имали су тенденцију да се чешће пријављују при вишим дозама, а углавном су били благи до умерени по јачини и обично нису захтевали прекид лечења АВАНДИА-ом.
У двоструко слепим студијама пријављена је анемија код 1,9% пацијената који су примали АВАНДИА као монотерапију у поређењу са 0,7% плацеба, 0,6% сулфонилурее и 2,2% метформина. Извештаји о анемији били су већи код пацијената лечених комбинацијом АВАНДИА и метформина (7,1%) и са комбинацијом АВАНДИА и сулфонилуреа плус метформин (6,7%) у поређењу са монотерапијом АВАНДИА или у комбинацији са сулфонилурејом (2.3%). Нижи ниво хемоглобина / хематокрита пред пацијентима укљученим у клиничка испитивања метформинских комбинација можда је допринео већој стопи пријављивања анемије у овим студијама [видети НЕЖЕЉЕНЕ РЕАКЦИЈЕ].
У клиничким испитивањима пријављен је едем код 4,8% пацијената који су примали АВАНДИА као монотерапију у поређењу са 1,3% плацебом, 1,0% сулфонилурее и 2,2% метформином. Стопа јављања едема била је већа за АВАНДИА 8 мг у комбинацијама сулфонилурее (12,4%) у поређењу с другим комбинацијама, са изузетком инсулина. Обележен је едем код 14,7% пацијената који су примали АВАНДИА у испитивањима комбинације инсулина у поређењу са 5,4% само на инсулину. Извештаји о новом почетку или погоршању конгестивне срчане инсуфицијенције јављају се са стопама од 1% само за инсулин, и 2% (4 мг) и 3% (8 мг) за инсулин у комбинацији са АВАНДИА [види БОКСЕД УПОЗОРЕЊЕ и УПОЗОРЕЊА И УПОЗОРЕЊЕ].
У студијама контролиране комбиноване терапије са сулфонилуреама пријављени су благи до умјерени хипогликемијски симптоми, за које се чини да су повезани са дозом. Мало је пацијената повучено због хипогликемије (<1%), а неколико епизода хипогликемије сматрало се тешким (<1%). Хипогликемија је најчешће пријављени нежељени догађај у испитивањима комбинације инзулина са фиксном дозом, иако се мало пацијената повукло због хипогликемије (4 од 408 за АВАНДИА плус инсулин и 1 од 203 за инсулин сама). Стопе хипогликемије, потврђене концентрацијом глукозе у капиларној крви ‰ мг мг мг 50 мг / дЛ, биле су 6% за сам инсулин и 12% (4 мг) и 14% (8 мг) за инсулин у комбинацији са АВАНДИА. [Види УПОЗОРЕЊА И УПОЗОРЕЊЕ.]
Дугорочно суђење АВАНДИЈИ као монотерапија
4- до 6-годишње истраживање (АДОПТ) упоредило је употребу АВАНДИА (н = 1,456), глибурида (н = 1,441) и метформина (н = 1,454) као монотерапија код пацијената недавно дијагностикованих дијабетеса типа 2 који претходно нису лечени антидијабетиком лекови. Табела 5 представља нежељене реакције без обзира на узрочност; стопе су изражене на 100 изложености болесника-година (ПИ) како би се узеле у обзир разлике у изложености испитиваним лековима у три групе лечења.
У АДОПТ-у пријављени су преломи код већег броја жена које су лечене АВАНДИА-ом (9.3%, 2.7 / 100) пацијент-године) у поређењу са глибуридом (3,5%, 1,3 / 100 пацијент-година) или метформином (5,1%, 1,5 / 100 године пацијента).
Већина прелома код жена које су примиле росиглитазон забиљежене су у надлактици, руци и стопалу. [Види УПОЗОРЕЊА И УПОЗОРЕЊЕ.] Запажена учесталост прелома код мушких пацијената била је слична у три групе лечења.
Табела 5. Нежељени догађаји на терапији (¥ Евентс 5 догађаја / 100 година пацијента [ПИ]) у било којој групи за лечење пријављени у 4- до 6-годишњем клиничком испитивању АВАНДИА-е као монотерапије (АДОПТ)
| АВАНДИА Н = 1,456 ПИ = 4.954 |
Глибуриде Н = 1,441 ПИ = 4.244 |
Метформин Н = 1,454 ПИ = 4.906 |
|
| Насофарингитис | 6.3 | 6.9 | 6.6 |
| Бол у леђима | 5.1 | 4.9 | 5.3 |
| Артралгија | 5.0 | 4.8 | 4.2 |
| Хипертензија | 4.4 | 6.0 | 6.1 |
| Инфекције горњих дисајних путева | 4.3 | 5.0 | 4.7 |
| Хипогликемија | 2.9 | 13.0 | 3.4 |
| Пролив | 2.5 | 3.2 | 6.8 |
Педијатријски
Авандиа је процењена на безбедност у једном, активно контролисаном испитивању педијатријских пацијената са дијабетесом типа 2 у коме је 99 лечено Авандиа-ом, а 101 лечено метформином. Најчешће нежељене реакције (> 10%) без узрочности за Авандиа или метформин биле су главобоља (17% према 14%), мучнина (4% према 11%), назофарингитис (3% према 12%) и пролив (1% према 1 13%). У овом истраживању забележен је један случај дијабетичке кетоацидозе у групи са метформином. Поред тога, у групи росиглитазона било је 3 пацијента који су имали ФПГ од 300 мг / дЛ, 2+ кетонурије и повишен јаз између аниона.
Лабораторијске неправилности
Хематолошка
Пад просјечног хемоглобина и хематокрита настао је на начин повезан с дозом код одраслих пацијената лијечених са Авандиа-ом (средња вредност смањења појединачних студија за чак 1,0 г / дЛ хемоглобина и чак 3,3% хематоцрит). Промене су се дешавале првенствено током прва 3 месеца након почетка терапије Авандиа-ом или након повећања дозе Авандиа-е. Временски ток и опсег смањења били су слични код пацијената лечених комбинацијом Авандије и других хипогликемијских лекова или монотерапије Авандаом. Ниво хемоглобина и хематокрита пред лечење је био нижи код пацијената у студијама комбинације метформина и можда је допринео већој стопи пријављивања анемије. У једном истраживању код педијатријских пацијената забележено је смањење хемоглобина и хематокрита (средњи пад од 0,29 г / дЛ и 0,95%, респективно). Мали пад хемоглобина и хематокрита забиљежен је и код педијатријских пацијената лијечених Авандиа-ом. Број белих крвних зрнаца се такође благо смањио код одраслих пацијената лечених Авандиа-ом. Смањење хематолошких параметара може бити повезано са повећаним волуменом плазме примећеним током лечења Авандиа-ом.
Липиди
Примећене су промене у серумским липидима после лечења Авандиа-ом код одраслих [види Клиничка фармакологија ]. Забележене су мале промене серумских липидних параметара код деце која су лечена Авандиа током 24 недеље.
Нивои трансаминаза у серуму
У клиничким студијама пре одобравања на 4.598 пацијената лечених Авандиа-ом (3.600 пацијената-година изложености) и у дугорочном 4- до Шестогодишње истраживање на 1.456 пацијената лечених Авандијом (4.954 године изложености пацијенту) није било доказа о индукованој лековима хепатотоксичност.
У контролисаним испитивањима пре одобрења, 0,2% пацијената лечених Авандиа-ом имало је повишење АЛТ> 3Кс горње границе нормале у поређењу са 0,2% код плацеба и 0,5% на активним компаратерима. Повишице АЛТ-а код пацијената лечених Авандиа-ом биле су реверзибилне. Хипербилирубинемија је нађена код 0,3% пацијената лечених Авандиа-ом у поређењу са 0,9% лечених плацебом и 1% код пацијената лечених активним компаратерима. У клиничким испитивањима која су претходила одобрењу није било случајева идиосинкратских реакција лијекова који би довели до затајења јетре. [Види Упозорења и мере предострожности]
У 4- до 6-годишњем испитивању АДОПТ-а, пацијенти лечени Авандиа-ом (4.954 изложености пацијената-година), глибуридом (4.244 изложености пацијенту-годинама) или метформин (4.906 година изложености пацијенту), као монотерапија, имао је исту стопу пораста АЛТ-а на> 3Кс горњу границу нормале (0,3 на 100 пацијент-година изложеност).
Постмаркетинг искуство
Поред нежељених реакција пријављених у клиничким испитивањима, догађаји описани у наставку идентификовани су током употребе Авандиа након одобрења. Пошто се ти догађаји пријављују добровољно из популације непознате величине, није могуће поуздано проценити њихову учесталост или увек успоставити узрочно-посљедичну везу са излагањем лековима.
Код пацијената који су примали терапију тиазолидиндионом, потенцијално озбиљни нежељени догађаји са или без смртног исхода везано за експанзију волумена (нпр. конгестивна срчана инсуфицијенција, плућни едем и плеурални излив) [види Бокед Варнинг и Упозорења и мере предострожности].
Постоје постмаркетиншки извештаји са Авандиа хепатитисом, повишењем јетрених ензима три или више пута више од горња граница нормале и затајење јетре са смртним исходом и без њега, мада узрочно није било успостављен.
Ретко су пријављени осип, пруритус, уртикарија, ангиоедем, анафилактичка реакција и Стевенс-Јохнсон синдром.
Примљени су и извештаји о новом појаву или погоршавању дијабетичког едема макуле са смањеном оштрином вида [види Упозорења и мере предострожности].
врх
Интеракције са лековима
Инхибитори и индуктори ЦИП2Ц8
Инхибитор ЦИП2Ц8 (нпр. Гемфиброзил) може повећати АУЦ росиглитазона, а индуктор ЦИП2Ц8 (нпр. Рифампин) може смањити АУЦ росиглитазона. Стога, ако се инхибитор или индуктор ЦИП2Ц8 покрене или заустави током лечења росиглитазоном, промене у лечењу дијабетеса могу бити потребне на основу клиничког одговора. [Види КЛИНИЧКА ФАРМАКОЛОГИЈА.]
врх
Употреба у одређеној популацији
Трудноћа
Трудноћа Категорија Ц.
Све трудноће имају позадински ризик од урођених мана, губитка или другог неповољног исхода, без обзира на изложеност лековима. Овај позадински ризик се повећава у трудноћама компликованим хипергликемијом и може се смањити добром метаболичком контролом. За пацијенте са дијабетесом или историјом гестацијског дијабетеса од суштинског је значаја да одржавају добру метаболичку контролу пре зачећа и током трудноће. Пажљиво праћење контроле глукозе је од суштинске важности код таквих болесника. Већина стручњака препоручује да се монотерапија инсулином користи током трудноће да би се ниво глукозе у крви одржао што ближе нормалној.
Људски подаци: Извештава се да Росиглитазон прелази кроз људску плаценту и може се детектирати у ткиву фетуса. Клинички значај ових налаза није познат. Не постоје адекватне и добро контролисане студије на трудницама. АВАНДИА се не сме користити током трудноће.
Студије на животињама: Није било ефекта на имплантацију или на ембрион лечењем росиглитазоном током ране трудноће код пацова, али третман током касне гестације био је повезан са смрћу фетуса и успоравањем раста и код пацова и код зечева. Тератогеност није примећена код доза до 3 мг / кг код пацова и 100 мг / кг код кунића (отприлике 20 и 75 пута хумане АУЦ од максималне препоручене дневне дозе за људе). Росиглитазон је изазвао патологију плаценте код пацова (3 мг / кг / дан). Третман пацова током гестације путем дојења смањио је величину легла, неонаталну одрживост и постнатални раст, са ретардацијом раста која је реверзибилна после пубертета. За ефекте на плаценту, ембрион / плод и потомство, доза без учинка била је 0,2 мг / кг / дан код пацова и 15 мг / кг / дан код кунића. Ови нивои без ефекта су приближно 4 пута веће од АУЦ људске вредности при максималној препорученој дневној дози за људе. Росиглитазон је смањио број имплантација материце и живо потомство када су малолетне женке пацова лечене на 40 мг / кг / дан од 27. дана до сексуалне зрелости (отприлике 68 пута хумане АУЦ максимално препоручене дневно доза). Ниво без ефекта био је 2 мг / кг / дан (отприлике 4 пута већа од АУЦ хумане вредности при највећој препорученој дневној дози). Није било ефекта на пре или постпотално преживљавање или раст.
Рад и испорука
Утицај росиглитазона на рад и порођај код људи није познат.
Неговане мајке
Материјал повезан са дрогом откривен је у млеку код пацова који су дојили. Није познато да ли се АВАНДИА излучује у мајчино млеко. Будући да се многи лекови излучују у мајчино млеко, АВАНДИА не треба давати негованој жени.
Педијатријска употреба
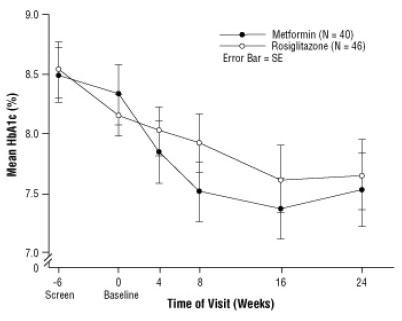
Након примене плацеба, укључујући саветовање о исхрани, деца са шећерном болешћу типа 2, узраста од 10 до 17 година и са основним средњим индексом телесне масе (БМИ) од 33 кг / м, насумично су подвргнути третману са 2 мг два пута дневно АВАНДИА (н = 99) или 500 мг два пута дневно метформином (н = 101) у 24 недељно, двоструко слепом клиничком суђење. Као што се очекивало, ФПГ се смањио код пацијената који су прешли на лекове против дијабетеса (н = 104) и повећао се код пацијената који су се повукли из претходних лекова (обично метформина) (н = 90) током периода у којем су учествовали. После најмање 8 недеља лечења, 49% пацијената лечених АВАНДИА и 55% пацијената лечених метформином удвостручило је своју дозу ако је ФПГ> 126 мг / дЛ. За укупну популацију са намером за лечење, у 24. недељу, средња промена од почетне вредности у ХбА1ц била је -0.14% са АВАНДИА и -0.49% са метформином. У овом истраживању није био довољан број пацијената да би се утврдило да ли су ови
уочени средњи ефекти лечења били су слични или различити. Ефекти лечења разликовали су се код пацијената који су били на терапији антидијабетичким лековима и код пацијената који су претходно лечени антидијабетичком терапијом (Табела 6).
Табела 6. 24. недеља ФПГ и ХбА1ц се пребацују са почетне последње проматране вредности код деце са основном линијом ХбА1ц> 6,5%
| НаА¯ве Патиентс | Претходно лечени пацијенти | |||
|
Метформин Н = 40 |
Росиглитазоне Н = 45 |
Метформин Н = 43 |
Росиглитазоне Н = 32 |
|
| ФПГ (мг / дЛ) | ||||
| Основна линија (средња вредност) | 170 | 165 | 221 | 205 |
| Промена од почетне (средње) | -21 | -11 | -33 | -5 |
| Прилагођена разлика у лечењу * (росиглитазон-метформин) - (95% ЦИ) | 8 (-15, 30) |
21 (-9, 51) |
||
| % пацијената са ¥ мг 30 мг / дЛ смањује се од почетне вриједности | 43% | 27% | 44% | 28% |
| ХбА1ц (%) | ||||
| Основна линија (средња вредност) | 8.3 | 8.2 | 8.8 | 8.5 |
| Промена од почетне (средње) | -0.7 | -0.5 | -0.4 | 0.1 |
| Прилагођена разлика у лечењу * (росиглитазон-метформин) - (95% ЦИ) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % пацијената са 0,7% смањења од почетне вриједности | 63% | 52% | 54% | 31% |
|
* Промјена од основне вриједности је најмање квадрата, прилагођавање за основну вриједност ХбА1ц, пол и регију. †Позитивне вредности разлике фаворизирају метформин. |
Разлике у лечењу зависиле су од почетног БМИ или тежине тако да су ефекти АВАНДИА и метформина изгледали ближе упоредивим међу тежим пацијентима. Медијан повећања телесне тежине био је 2,8 кг са росиглитазоном и 0,2 кг са метформином [видети УПОЗОРЕЊА И УПОЗОРЕЊЕ]. Педесет и четири процента пацијената лечених росиглитазоном и 32% пацијената лечених метформином стекло је 2 кг, а 33% пацијената лечених росиглитазоном и 7% пацијената лечених метформином добило је 5 кг на студија.
Нежељени догађаји примећени у овој студији описани су у Нежељеним реакцијама).
Слика 3. Средња вредност ХбА1ц током времена у 24-недељном истраживању АВАНДИА и метформина код педијатријских пацијената - подгрупа за лекове
Геријатријска употреба
Резултати популацијске фармакокинетичке анализе показали су да старост не утиче значајно на фармакокинетику росиглитазона [види КЛИНИЧКА ФАРМАКОЛОГИЈА]. Због тога није потребно прилагођавање дозе старијим особама. У контролисаним клиничким испитивањима нису примећене свеукупне разлике у безбедности и ефикасности између старијих (¥ ¥ 65 година) и млађих (<65 година) пацијената.
врх
Предозирање
Ограничени су подаци о предозирању код људи. У клиничким студијама на добровољцима, АВАНДИА се примењивала у једнократним оралним дозама до 20 мг и добро се толерисала. У случају предозирања потребно је започети одговарајући супортивни третман како то диктира клинички статус пацијента.
врх
Опис
АВАНДИА (росиглитазон малеат) је орално антидијабетичко средство које делује пре свега повећањем осетљивости на инзулин. АВАНДИА побољшава контролу гликемије уз смањење нивоа инзулина у циркулацији.
Росиглитазон малеат није хемијски или функционално повезан са сулфонилуреама, бигуанидима или инхибиторима алфа-глукозидазе.
Хемијски, малезиат росиглитазон је (±) -5 - [[4- [2- (метил-2-пиридиниламино) етокси] фенил] метил] -2,4-тиазолидиндион, (З) -2-бутендиоат (1: 1) са молекулском тежином од 473,52 (слободна база 357,44). Молекул има једно кирално средиште и присутан је као рацемати. Због брзе интерконверзије, енантиомери се функционално не разликују. Структурна формула росиглитазон малеута је:
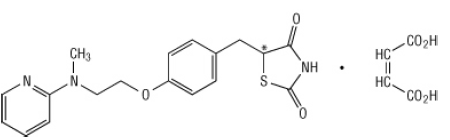
Молекуларна формула је Ц18Х19Н3О3С-Ц4Х4О4. Росиглитазон малеат је бела до сива чврста супстанца са опсегом талишта од 122 до 123 ° Ц. Вредности пКа росиглитазон малеута су 6,8 и 6,1. Лако је растворљив у етанолу и а пуферирани водени раствор са пХ 2,3; растворљивост се смањује с повећањем пХ у физиолошком домет.
Свака петерокутна филмом обложена таблета ТИЛТАБ садржи росиглитазон малеат еквивалент росиглитазону, 2 мг, 4 мг или 8 мг, за оралну примену. Неактивни састојци су: Хипромеллосе 2910, лактоза монохидрат, магнезијум стеарат, микрокристална целулоза, полиетилен гликол 3000, натријум-шкробни гликолат, титанијум-диоксид, триацетин и 1 или више од следећег: Синтетички оксиди црвеног и жутог гвожђа и талк.
врх
Клиничка фармакологија
Механизам дејства
Росиглитазон, припадник антидијабетичких средстава тиазолидиндион, побољшава контролу гликемије побољшавајући осетљивост на инзулин. Росиглитазон је високо селективан и моћан агонист за рецептор-гама-активиран пролифератором пролифератором (ППАР3). У људи се ППАР рецептори налазе у кључним циљаним ткивима за деловање инсулина, као што су масно ткиво, скелетни мишићи и јетра. Активација нуклеарних рецептора ППАР3 регулише транскрипцију гена који реагују на инсулин, који учествују у контроли производње, транспорта и употребе глукозе. Поред тога, гени који реагују на ППАРИ³ такође учествују у регулацији метаболизма масних киселина.
Инзулинска резистенција је уобичајена карактеристика која карактерише патогенезу дијабетеса типа 2. Антидијабетичка активност росиглитазона демонстрирана је на животињским моделима дијабетеса типа 2 у која је хипергликемија и / или ослабљена толеранција на глукозу последица инсулинске резистенције у мета марамице. Росиглитазон смањује концентрацију глукозе у крви и смањује хиперинзулинемију код об / гојазног миша, дб / дб дијабетичког миша и фа / фа масног Зуцкер пацова.
У животињским моделима показало се да антидијабетичка активност росиглитазона посредује повећаном осетљивошћу на деловање инсулина у јетри, мишићима и масном ткиву. Фармаколошка испитивања на животињским моделима показују да росиглитазон инхибира јетрену глуконеогенезу. Експресија инсулинско регулисаног транспортера глукозе ГЛУТ-4 је повећана у масном ткиву. Росиглитазон није изазвао хипогликемију у животињским моделима дијабетеса типа 2 и / или ослабљену толеранцију на глукозу.
Фармакодинамика
Пацијенти с липидним поремећајима нису искључени из клиничких испитивања АВАНДИА.
У свим 26-недељним контролисаним испитивањима, током препорученог распона доза, АВАНДИА као монотерапија била је повезана са повећањем укупног холестерола, ЛДЛ и ХДЛ и смањењем слободних масних киселина. Ове промене су се статистички значајно разликовале од контроле плацеба или глибурида (Табела 7).
Повећање ЛДЛ-а десило се првенствено током првих 1 до 2 месеца терапије АВАНДИА-ом, а ниво ЛДЛ остао је повишен изнад почетног нивоа током свих испитивања. Супротно томе, ХДЛ је наставио да расте током времена. Као резултат, однос ЛДЛ / ХДЛ је достигао врхунац након 2 месеца терапије, а затим се с временом чинило да опада. Због временске природе промене липида, 52-недељна студија под контролом глибурида је најрелевантнија за процену дугорочних ефеката на липиде. На почетку, 26. и 52. недеља, средњи омјери ЛДЛ / ХДЛ били су 3,1, 3,2 и 3,0 за АВАНДИА 4 мг два пута дневно. Одговарајуће вредности за глибурид биле су 3,2, 3,1 и 2,9. Разлике у промени у односу на почетну вредност између АВАНДИА и глибурида у 52. недељи биле су статистички значајне.
Образац промјена ЛДЛ и ХДЛ након терапије АВАНДИА-ом у комбинацији са другим хипогликемијским агенсима био је углавном сличан ономе који је виђен са АВАНДИА током монотерапије.
Промене триглицерида током терапије АВАНДИА-ом биле су променљиве и углавном се статистички нису разликовале од контроле плацеба или глибурида.
Табела 7. Резиме средњих промена липида у 26-недељним плацебо-контролисаним и 52-недељним студијама монотерапије са глибуридом
| Плацебо-контролисане студије, 26. недеља | Седмица 26. и 52. недеља контролисана глибуридом | ||||||
| Плацебо | АВАНДИА | Титрација глибурида | АВАНДИА 8 мг | ||||
| 4 мг дневно * | 8 мг дневно * | Вк 26 | Вк 52 | Вк 26 | Вк 52 | ||
| Слободне масне киселине | |||||||
| Н | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Основна вредност (средња вредност)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Промена од почетне (средње) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| ЛДЛ | |||||||
| Н | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Основна вредност (средња вредност)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Промена од почетне (средње) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| ХДЛ | |||||||
| Н | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Основна вредност (средња вредност)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Промена од почетне (средње) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Комбиноване су групе за дозирање једном и два пута дневно. |
Фармакокинетика
Максимална концентрација у плазми (Цмак) и површина испод кривуље (АУЦ) росиглитазона повећавају се пропорционално са дозом у распону терапијских доза (Табела 8). Полуживот елиминације је 3 до 4 сата и не зависи од дозе.
Табела 8. Средњи (СД) фармакокинетички параметри за Росиглитазон после појединачних оралних доза (Н = 32)
| Параметар | 1 мг наташте | 2 мг Посно | 8 мг наташте | 8 мг Фед |
| АУЦ0-инф [нг-хр / мЛ] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Цмак [нг / мЛ] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Полу живот [хр] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| ЦЛ / Ф * [Л / хр] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * ЦЛ / Ф = Орални зазор. |
Апсорпција
Апсолутна биорасположивост росиглитазона износи 99%. Највиша концентрација у плазми примећује се око 1 сат након дозирања. Примена росиглитазона са храном није резултирала променом укупне изложености (АУЦ), али дошло је до смањења Цмак за око 28% и кашњења у Тмак (1.75 сати). Те промене вероватно неће бити клинички значајне; стога се АВАНДИА може давати са или без хране.
Дистрибуција
Просечна (ЦВ%) орална запремина дистрибуције (Всс / Ф) росиглитазона је приближно 17,6 (30%) литара, на основу популационе фармакокинетичке анализе. Росиглитазон се приближно 99,8% везује за протеине плазме, пре свега албумин.
Метаболизам
Росиглитазон се интензивно метаболизује, а непромењени лек се не излучује у урину. Главни путеви метаболизма су Н-деметилација и хидроксилација, праћена коњугацијом са сулфатом и глукуронском киселином. Сви циркулирајући метаболити знатно су мање јачи од родитеља и, стога, не очекује се да доприносе активностима сензибилизације розиглитазона на инсулин.
Подаци ин витро показују да се росиглитазон претежно метаболизује изоензимом 2Ц8 цитокрома П450 (ЦИП), при чему ЦИП2Ц9 доприноси као споредни пут.
Излучивање
Након оралне или интравенске примене [14Ц] росиглитазон малеута, отприлике 64% и 23% дозе је елиминисано у урину и у измету. Полуживот у плазми од материјала [14Ц] кретао се у распону од 103 до 158 сати.
Популацијска фармакокинетика код пацијената са дијабетесом типа 2
Популацијске фармакокинетичке анализе из 3 велика клиничка испитивања, укључујући 642 мушкарца и 405 жена са дијабетесом типа 2 (у доби од 35 година до 80 година) показали да на старост, расу, пушење или алкохол не утичу фармакокинетика росиглитазона. потрошња. Показало се да и орални клиренс (ЦЛ / Ф) и запремина дистрибуције у устаљеном стању (Всс / Ф) повећавају се с повећањем телесне тежине. У опсегу тежине примећеним у овим анализама (50 до 150 кг), распон предвиђених вредности ЦЛ / Ф и Всс / Ф варирао је <1,7 пута, односно <2,3 пута, респективно.
Поред тога, показало се да на ЦЛ / Ф росиглитазона утиче и тежина и пол, и да је нижи (око 15%) код пацијената.
Посебне популације
Геријатријски
Резултати популацијске фармакокинетичке анализе (н = 716 <65 година; н = 331 ‰ ¥ 65 година) показало је да старост не утиче значајно на фармакокинетику росиглитазона.
Пол
Резултати анализе популацијске фармакокинетике показали су да је средњи орални клиренс росиглитазона у пацијенткиња (н = 405) била је приближно 6% нижа у поређењу с пацијентима исте телесне тежине (н = 642).
Као монотерапија и у комбинацији са метформином, АВАНДИА је побољшала контролу гликемије и код мушкараца и код жена. У студијама комбинације метформина, ефикасност је доказана без разлике у половима гликемијског одговора.
У монотерапијским студијама примећен је већи терапеутски одговор код жена; међутим, код више гојазних пацијената разлике у половима су мање евидентне. За дати индекс телесне масе (БМИ), жене имају већу масну масу од мушкараца. Будући да је молекуларна мета ППАР3 изражена у масном ткиву, ова диференцирајућа карактеристика може, барем делимично, давати већи одговор на женку АВАНДИА. С обзиром да терапија треба бити индивидуализована, није потребно прилагођавање дозе на основу самог пола.
Оштећење јетре
Невезани орални клиренс росиглитазона био је значајно нижи код пацијената са умереном до тешком болешћу јетре (Цхилд-Пугх класа Б / Ц) у поређењу са здравим особама. Као резултат, невезани Цмак и АУЦ0-инф су повисени 2- и 3-пута, респективно. Полуживот елиминације росиглитазона био је око 2 сата дужи код пацијената са обољењем јетре, у поређењу са здравим особама.
Терапија АВАНДИА-ом не треба започети ако пацијент покаже клиничке доказе о активности болест јетре или повећани ниво трансаминазе у серуму (АЛТ> 2,5Кс горња граница нормале) на почетној основи [види УПОЗОРЕЊА И УПОЗОРЕЊЕ].
Педијатријски
Фармакокинетички параметри росиглитазона код педијатријских пацијената утврђени су коришћењем популацијске фармакокинетичке анализе са ријетким подацима 96 педијатријских пацијената у једном педијатријском клиничком испитивању укључујући 33 мушкарца и 63 жене у узрасту од 10 до 17 година (тежине у распону од 35 до 178,3 кг). Средња вредност становништва ЦЛ / Ф и В / Ф росиглитазона била је 3,15 Л / хр, односно 13,5 Л, респективно. Ове процене ЦЛ / Ф и В / Ф биле су у складу са типичним проценама параметара из претходне анализе одрасле популације.
Оштећење бубрега
Нема клинички значајних разлика у фармакокинетики росиглитазона код пацијената са благом до тешког оштећења бубрега или код пацијената зависних од хемодијализе, у поређењу са пацијентима са нормалним бубрегом функција. Стога није потребно прилагођавање дозе код таквих пацијената који примају АВАНДИА. Пошто је метформин контраиндициран код пацијената са оштећењем бубрега, примена метформина са АВАНДИА је контраиндицирана код ових болесника.
Трка
Резултати популацијске фармакокинетичке анализе која укључује испитанице кавкаског, црног и другог етничког порекла показују да раса нема утицаја на фармакокинетику росиглитазона.
Интеракције љекова и дрога
Лекови који инхибирају, изазивају или метаболишу Цитоцхроме П450
Студије метаболизма лекова ин витро сугерирају да росиглитазон не инхибира ниједан од главних ензима П450 у клинички релевантним концентрацијама. Подаци ин витро показују да се росиглитазон претежно метаболизује ЦИП2Ц8, ау мањој мери и 2Ц9. Показало се да АВАНДИА (4 мг два пута дневно) нема клинички значајан ефекат на фармакокинетику лекова нифедипин и орални контрацептиви (етинил естрадиол и норетиндрон), који се претежно метаболишу од ЦИП3А4
Гемфиброзил
Истодобна примена гемфиброзила (600 мг два пута дневно), инхибитора ЦИП2Ц8 и росиглитазона (4 мг једном дневно) током 7 дана повећао АУЦ росиглитазона за 127%, у поређењу са применом росиглитазона (4 мг једном дневно) сама. С обзиром на потенцијал нежељених догађаја повезаних са дозом росиглитазона, можда ће бити потребно смањење дозе росиглитазона када се уводи гемфиброзил [видети ИНТЕРАКЦИЈЕ ЛИЈЕКОВА].
Рифампин
За употребу рифампина (600 мг једном дневно), индуктора ЦИП2Ц8, током 6 дана смањује се АУЦ росиглитазона за 66%, у поређењу са применом само росиглитазона (8 мг) [види ИНТЕРАКЦИЈЕ ЛИЈЕКОВА].4
Глибуриде
АВАНДИА (2 мг два пута дневно) узимана истодобно с глибуридом (3,75 до 10 мг / дан) током 7 дана није се променила средња 24-сатна концентрација глукозе у плазми у пацијената са дијабетиком стабилизована на глибуриду терапија. Понављање доза АВАНДИА (8 мг једном дневно) током 8 дана код здравих одраслих испитаника кавкаске популације изазвало је смањење АУЦ и Цмак глибурида за отприлике 30%. Код јапанских испитаника, АУЦ и Цмак глибурида незнатно су порасли након примене АВАНДИА.
Глимепирид
Једнократне оралне дозе глимепирида код 14 здравих одраслих испитаника нису имале клинички значајан утицај на фармакокинетику АВАНДИА у стању стабилности. Нема клинички значајних смањења АУЦ и Ц глимепиридамак примећене су након понављаних доза АВАНДИА (8 мг једном дневно) током 8 дана код здравих одраслих испитаника.
Метформин
Истодобна примена АВАНДИА (2 мг два пута дневно) и метформина (500 мг два пута дневно) код здравих добровољци 4 дана нису имали утицаја на фармакокинетику устаљеног стања било метформина, било росиглитазоне.
Ацарбосе
Истодобна примена акарбозе (100 мг три пута дневно) током здравих добровољаца није имала клинички значајан ефекат на фармакокинетику једне оралне дозе АВАНДИА.
Дигоксин
Понављање оралног дозирања АВАНДИА (8 мг једном дневно) током 14 дана није променило фармакокинетику дигоксина у стању стабилности (0,375 мг једном дневно) код здравих добровољаца.
Варфарин
Поновљено дозирање са АВАНДИА није имало клинички релевантан утицај на стабилну фармакокинетику варфаринских енантиомера у стању стабилности.
Етанол
Појединачна примена умерене количине алкохола није повећала ризик од акутне хипогликемије код болесника са шећерном болешћу типа 2 који су лечени АВАНДИА.
Ранитидин
Претходно лечење ранитидином (150 мг два пута дневно током 4 дана) није променило фармакокинетику ни појединих оралних ни интравенских доза росиглитазона код здравих добровољаца.
Ови резултати сугерирају да апсорпција оралног росиглитазона није измењена у условима праћеним порастом гастроинтестиналног пХ.
врх
Неклиничка токсикологија
Канцерогенеза, мутагенеза, оштећење плодности
Карциногенеза:
Двогодишње истраживање канцерогености је спроведено на мишевима ЦД-1 Ривер Цхарлес у дози од 0,4, 1,5 и 6 мг / кг / дан у дијета (највећа доза еквивалентна приближно 12 пута већој АУЦ људској вредности при максимално препорученом људском дневно доза). Пацовима Спрагуе-Давлеи дозиране су две године оралним газзирањем у дозама од 0,05, 0,3 и 2 мг / кг / дан (највећи еквивалент дозе до приближно 10 и 20 пута веће АУЦ људске вредности при максималној препорученој дневној дози за мушкарце и жене пацова, редом).
Росиглитазон није био канцероген у миша. Дошло је до повећања инциденције хиперплазије масне киселине код миша у дозама 1,5 мг / кг / дан (отприлике 2 пута веће од АУЦ хумане у максималној препорученој дневној дози за човека). Код пацова је примећен значајан пораст учесталости бенигних тумора масног ткива (липоми) у дози 0,3 мг / кг / дан (приближно 2 пута већа од АУЦ-а од човека при највећој препорученој дневној дози за човека). Ове пролиферативне промене код обе врсте се узимају у обзир због упорне фармаколошке прекомерне стимулације масног ткива.
Мутагенеза:
Росиглитазон није био мутаген или кластоген у ин витро бактеријским тестовима за мутацију гена, ин витро тест аберације хромозома у хуманим лимфоцитима, ин виво тест микронуклеуса миша и ин виво / ин витро пацов УДС тест. Дошло је до малог (око двоструког) пораста мутације у тесту ин витро мишјег лимфома у присуству метаболичке активације.
Оштећење плодности:
Росиглитазон није имао ефекта на парење или плодност мушких пацова који су добијали до 40 мг / кг / дан (отприлике 116 пута већу АУЦ од човека при највећој препорученој дневној дози за људе). Росиглитазон је променио естро-цикличност (2 мг / кг / дан) и смањио плодност (40 мг / кг / дан) женки пацова у комбинацији са нижим ниво прогестерона и естрадиола у плазми (приближно 20 и 200 пута хумане АУЦ при максималној препорученој дневној дози за људе, редом). Нису забележени такви ефекти код 0,2 мг / кг / дан (отприлике 3 пута хумане АУЦ при максималној препорученој дневној дози за човека). Код малолетних пацова дозираних од 27. дана до полне зрелости (до 40 мг / кг / дан) није било ефекта на репродуктивну способност мушкараца, или о катастрофалној цикличности, перформанси парења или инциденцији трудноће код жена (отприлике 68 пута већа од АУЦ људске вредности при максимално препорученом људском дневном дневнику доза). Код мајмуна росиглитазон (0,6 и 4,6 мг / кг / дан; приближно 3 и 15 пута већа од АУЦ хумане максималне препоручене дневне дозе за човека) смањила је пораст фоликуларне фазе у серум естрадиолу са последичним смањењем пораста лутеинизујућег хормона, нижим нивоима прогестерона у лутеалној фази и аменореја Механизам ових ефеката изгледа као директна инхибиција стероидогенезе јајника.
Токицологи за животиње
Повећана је тежина срца код мишева (3 мг / кг / дан), пацова (5 мг / кг / дан) и паса (2 мг / кг / дан) са росиглитазоном третмане (отприлике 5, 22 и 2 пута хумане АУЦ при максималној препорученој дневној дози за људе, респективно). Ефекти код малолетних пацова били су у складу са онима који су примећени код одраслих. Морфометријско мерење указало је на постојање хипертрофије у срчаним вентрикуларним ткивима, што може бити последица повећаног рада срца као последица проширења волумена у плазми.
врх
Клиничке студије
Монотерапија
У клиничким студијама, лечење АВАНДИА-ом је резултирало побољшањем контроле гликемије, мерено ФПГ-ом и ХбА1ц, уз истовремено смањење инсулина и Ц-пептида. Постпрандијална глукоза и инзулин такође су смањени. Ово је у складу са механизмом деловања АВАНДИА-е као инзулинског сензибилизатора.
Максимална препоручена дневна доза је 8 мг. Студије распона дозе сугерисале су да није остварена додатна корист са укупном дневном дозом од 12 мг.
Краткорочне клиничке студије: Укупно 2315 пацијената са дијабетесом типа 2, претходно лечених дијетом или антидијабетичким лековима, лечено је АВАНДИА-ом као монотерапија у 6 двоструко слепих студије, које су укључивале две 26-недељне плацебо-контролисане студије, једно истраживање које је контролисано глибуридом од 52 недеље и 3 студије у распону дозе у трајању од 8 до 12 недеља. Претходни антидијабетички лекови су повучени и пацијенти су ушли у период од 2 до 4 недеље плацеба пре рандомизације.
Два 26-недељна двоструко слепа испитивања плацебом контролисана код пацијената са дијабетесом типа 2 (н = 1,401) са неадекватним гликемије контрола (средња основна вриједност ФПГ отприлике 228 мг / дЛ [101 до 425 мг / дЛ] и средња основна вриједност ХбА1ц 8,9% [5,2% до 16,2%]), спроведено. Лечење АВАНДИА-ом је донело статистички значајна побољшања ФПГ и ХбА1ц у поређењу са почетном и у односу на плацебо. Подаци једне од ових студија сумирани су у Табели 9.
Табела 9: Гликемијски параметри у 26-недељном плацебо-контролираном испитивању
| Плацебо Н = 173 |
АВАНДИА | АВАНДИА | |||
| 4 мг једном дневно Н = 180 |
2 мг два пута дневно Н = 186 |
8 мг једном дневно Н = 181 |
4 мг два пута дневно Н = 187 |
||
| ФПГ (мг / дЛ) | |||||
| Основна линија (средња вредност) | 225 | 229 | 225 | 228 | 228 |
| Промена од почетне (средње) | 8 | -25 | -35 | -42 | -55 |
| Разлика од плацеба (прилагођени просек) | - | -31* | -43* | -49* | -62* |
| % пацијената са ¥ мг 30 мг / дЛ смањује се од почетне вриједности | 19% | 45% | 54% | 58% | 70% |
| ХбА1ц (%) | |||||
| Основна линија (средња вредност) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Промена од почетне (средње) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Разлика од плацеба (прилагођени просек) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % пацијената са 0,7% смањења од почетне вриједности | 9% | 28% | 29% | 39% | 54% |
| * п <0,0001 у поређењу са плацебом. |
Када се примењује у истој укупној дневној дози, АВАНДИА је углавном ефикаснија у смањењу ФПГ и ХбА1ц када се примењује у подељеним дозама два пута дневно у поређењу са дозама једном дневно. Међутим, за ХбА1ц, разлика између доза од 4 мг једном дневно и 2 мг два пута дневно није била статистички значајна.
Дугорочне клиничке студије
Дуготрајно одржавање ефекта оцењено је у двоструко слепом испитивању са двоструко слепим гликуридима код пацијената са дијабетесом типа 2. Пацијенти су били рандомизирани на лечење АВАНДИА 2 мг два пута дневно (Н = 195) или АВАНДИА 4 мг два пута дневно (Н = 189) или глибуридом (Н = 202) током 52 недеље. Пацијентима који су примали глибурид дата је почетна доза од 2,5 мг / дан или 5,0 мг / дан. Дозирање је затим титровано у корацима од 2,5 мг / дан током наредних 12 недеља, до максималне дозе од 15,0 мг / дан у циљу оптимизације гликемијске контроле. Након тога, доза глибурида је одржавана константном.
Средња титрована доза глибурида била је 7,5 мг. Сви третмани резултирали су статистички значајним побољшањем контроле гликемије од почетне вриједности (Слика 4 и Слика 5). На крају 52. недеље, смањење од ФПГ и ХбА1ц од почетне вредности износило је -40,8 мг / дЛ и -0,53% са АВАНДИА 4 мг два пута дневно; -25,4 мг / дЛ и -0,27% са АВАНДИА 2 мг два пута дневно; и -30.0 мг / дЛ и -0.72% са глибуридом. За ХбА1ц, разлика између АВАНДИА 4 мг два пута дневно и глибурида није била статистички значајна у 52. недељи. Почетни пад ФПГ са глибуридом био је већи него код АВАНДИА; међутим, овај ефекат је временом био мање трајан.
Побољшање контроле гликемије које је примећено АВАНДИА 4 мг два пута дневно у 26. недељи одржано је кроз 52 недељу испитивања.
Слика 4. Средња вредност ФПГ-а током времена у 52-недељној студији која је контролисана глибуридом

Слика 5. Средња вредност ХбА1ц током времена у 52-недељној студији која је контролисана глибуридом

Забележена је хипогликемија код 12,1% болесника лечених глибуридом у поређењу са 0,5% (2 мг два пута дневно) и 1,6% (4 мг два пута дневно) пацијената лечених АВАНДИА-ом. Побољшања контроле гликемије била су повезана са средњим повећањем тежине од 1,75 кг и 2,95 кг за пацијенти лечени са 2 мг и 4 мг два пута дневно АВАНДИА, у поређењу са 1,9 кг лечених глибуридом пацијенти. Код пацијената лечених АВАНДИА-ом били су Ц-пептид, инсулин, про-инсулин и раздвојени про-инсулин значајно смањена на начин који је одређиван дозом, у поређењу са повећањем лечења глибуридом пацијенти.
Испитивање исхода исхода дијабетеса (АДОПТ) било је вишецентрично, двоструко слепо, контролисано испитивање (Н = 4,351), спроведено током 4 до 6 година да би се упоредили безбедност и ефикасност монотерапије АВАНДИА-ом, метформином и глибуридом код пацијената недавно дијагностикованих дијабетес мелитуса типа 2 (‰ иеарс 3 године), који нису правилно контролисани исхраном и вежба. Просечна старост пацијената у овом испитивању била је 57 година, а већина пацијената (83%) није имала историју кардиоваскуларних болести. Средња вриједност ФПГ и ХбА1ц била је 152 мг / дЛ, односно 7,4%. Пацијенти су рандомизирани да примају или АВАНДИА 4 мг једном дневно, глибурид 2,5 мг једном дневно, или метформин 500 мг једном дневно, и дозе су титровано до оптималне контроле гликемије до максимално 4 мг два пута дневно за АВАНДИА, 7,5 мг два пута дневно за глибурид и 1.000 мг два пута дневно за метформин. Примарни исход ефикасности био је време до узастопног ФПГ> 180 мг / дЛ након најмање 6 недеља лечења максимално толерисану дозу лека за испитивање или време до неадекватне контроле гликемије, како је утврђено независним пресудом одбор.
Кумулативна учесталост примарног исхода ефикасности за 5 година била је 15% код АВАНДИА, 21% са метформином и 34% са глибуридом (омјер опасности 0,68 [95% ЦИ 0,55, 0,85] у односу на метформин, ХР 0,37 [95% ЦИ 0,30, 0,45] у односу на глибурид).
Подаци о кардиоваскуларним и нежељеним догађајима (укључујући ефекте на телесну тежину и лом костију) од АДОПТ за АВАНДИА, метформин и глибурид су описани у УПОЗОРЕЊА И УПОЗОРЕЊЕ и НЕЖЕЉЕНЕ РЕАКЦИЈЕ, редом. Као и код свих лекова, резултати ефикасности морају се узети у обзир заједно са информацијама о безбедности како би се проценила потенцијална корист и ризик за појединог пацијента.
Комбинација са Метформином или Сулфонилуреом
Додавање АВАНДИА или метформину или сулфонилуреји довело је до значајног смањења хипергликемије у поређењу са било којим од ових лекова. Ови резултати су у складу са адитивним ефектом на контролу гликемије када се АВАНДИА користи као комбинована терапија.
Комбинација са метформином
Укупно 670 пацијената са дијабетесом типа 2 учествовало је у две, недељно рандомизоване, двоструко слепе, плацебо / активно контролисане студије дизајниране за процену ефикасности АВАНДИА у комбинацији са метформин. АВАНДИА, која се примењује у режиму дозирања једном или два пута дневно, додата је терапији пацијената који су били неадекватно контролисани максималном дозом (2,5 грама / дан) метформина.
У једној студији, пацијенти су неадекватно контролисали 2,5 грама метформина на дан (средња вредност ФПГ 216 мг / дЛ и средња основна вредност ХбА1ц 8,8%) насумично је примао 4 мг АВАНДИА једном дневно, 8 мг АВАНДИА једном дневно или плацебо метформин. Запажено је статистички значајно побољшање ФПГ и ХбА1ц код пацијената лечених комбинацијама метформин и 4 мг АВАНДИА једном дневно и 8 мг АВАНДИА једном дневно, за разлику од пацијената који су наставили само са метформином (Табела 10).
Табела 10. Гликемијски параметри у 26-недељном комбинованом студију АВАНДИА Плус Метформина
| Метформин Н = 113 |
АВАНДИА 4 мг једном дневно + метформин Н = 116 |
АВАНДИА 8 мг једном дневно + метформин Н = 110 |
|
| ФПГ (мг / дЛ) | |||
| Основна линија (средња вредност) | 214 | 215 | 220 |
| Промена од почетне (средње) | 6 | -33 | -48 |
| Разлика од самог метформина (прилагођени средњи ниво) | - | -40* | -53* |
| % пацијената са ¥ мг 30 мг / дЛ смањује се од почетне вриједности | 20% | 45% | 61% |
| ХбА1ц (%) | |||
| Основна линија (средња вредност) | 8.6 | 8.9 | 8.9 |
| Промена од почетне (средње) | 0.5 | -0.6 | -0.8 |
| Разлика од самог метформина (прилагођени средњи ниво) | - | -1.0* | -1.2* |
| % пацијената са 0,7% смањења од почетне вриједности | 11% | 45% | 52% |
| * п <0,0001 у поређењу са метформином. |
У другој студији у трајању од 26 недеља, пацијенти са дијабетесом типа 2 неадекватно су контролисали 2,5 грама метформина / дан који су били рандомизовани да примају комбинацију АВАНДИА 4 мг два пута дневно и метформин (Н = 105) показао је статистички значајно побољшање контроле гликемије са средњим ефектом лечења за ФПГ од -56 мг / дЛ и средњим ефектом лечења за ХбА1ц од -0,8% у односу на метформин сам. Комбинација метформина и АВАНДИА резултирала је нижим нивоима ФПГ-а и ХбА1ц него сам.
Пацијенти који су били неадекватно контролисани на максималној дози (2,5 грама дневно) и који су били пребачен на монотерапију АВАНДИА показао је губитак гликемијске контроле, о чему сведочи повећање ФПГ и ХбА1ц. У овој групи је такође примећено повећање ЛДЛ-а и ВЛДЛ-а.
Комбинација са сулфонилурејом
Укупно 3.457 пацијената са дијабетесом типа 2 учествовало је у десет рандомизираних, двоструко слепих, плацебо / активно контролисаних студија од 24 до 26 недеља и у једној Двогодишње слепо, активно контролисано истраживање код старијих пацијената дизајнирано за процену ефикасности и сигурности АВАНДИА у комбинацији са сулфонилуреа. АВАНДИА је давана 2 мг, 4 мг или 8 мг дневно, било једном дневно (3 студије) или у подељеним дозама два пута дневно (7 студија), пацијентима који нису адекватно контролисани на субмаксималној или максималној дози сулфонилуреа.
У овим истраживањима, комбинација АВАНДИА 4 мг или 8 мг дневно (која се даје у појединачним или два пута дневно подељеним дозама) и а сулфонилуреа је значајно смањила ФПГ и ХбА1ц у поређењу са плацебом плус сулфонилурејом или даљом надоградњом сулфонилуреа. Табела 11 приказује сакупљене податке за 8 студија у којима је АВАНДИА додата сулфонилуреи у поређењу са плацебом и сулфонилурејом.
Табела 11. Гликемијски параметри у комбинованим студијама од 24 до 26 недеља АВАНДИА Плус Сулфонилуреа
| Два пута дневно подељено дозирање (5 студија) | Сулфонилуреа Н = 397 |
АВАНДИА 2 мг два пута дневно + сулфонилуреа Н = 497 |
Сулфонилуреа Н = 248 |
АВАНДИА 4 мг два пута дневно + сулфонилуреа Н = 346 |
| ФПГ (мг / дЛ) | ||||
| Основна линија (средња вредност) | 204 | 198 | 188 | 187 |
| Промена од почетне (средње) | 11 | -29 | 8 | -43 |
| Разлика од саме сулфонилуреје (прилагођени просек) | - | -42* | - | -53* |
| % пацијената са ¥ мг 30 мг / дЛ смањује се од почетне вриједности | 17% | 49% | 15% | 61% |
| ХбА1ц (%) | ||||
| Основна линија (средња вредност) | 9.4 | 9.5 | 9.3 | 9.6 |
| Промена од почетне (средње) | 0.2 | -1.0 | 0.0 | -1.6 |
| Разлика од саме сулфонилуреје (прилагођени просек) | - | -1.1* | - | -1.4* |
| % пацијената са 0,7% смањења од почетне вриједности | 21% | 60% | 23% | 75% |
| Дозирање једном дневно (3 студије) | Сулфонилуреа Н = 172 |
АВАНДИА 4 мг једном дневно + сулфонилуреа Н = 172 |
Сулфонилуреа Н = 173 |
АВАНДИА 8 мг једном дневно + сулфонилуреа Н = 176 |
| ФПГ (мг / дЛ) | ||||
| Основна линија (средња вредност) | 198 | 206 | 188 | 192 |
| Промена од почетне (средње) | 17 | -25 | 17 | -43 |
| Разлика од саме сулфонилуреје (прилагођени просек) | - | -47* | - | -66* |
| % пацијената са ¥ мг 30 мг / дЛ смањује се од почетне вриједности | 17% | 48% | 19% | 55% |
| ХбА1ц (%) | ||||
| Основна линија (средња вредност) | 8.6 | 8.8 | 8.9 | 8.9 |
| Промена од почетне (средње) | 0.4 | -0.5 | 0.1 | -1.2 |
| Разлика од саме сулфонилуреје (прилагођени просек) | - | -0.9* | - | -1.4* |
| % пацијената са 0,7% смањења од почетне вриједности | 11% | 36% | 20% | 68% |
| * п <0,0001 у поређењу са само сулфонилурејом. |
Једна од студија од 24 до 26 недеља укључивала је пацијенте који су били неадекватно контролисани максималним дозама глибурида и прелазили су на 4 мг АВАНДИА дневно као монотерапију; у овој групи је доказан губитак контроле гликемије, о чему сведочи повећање ФПГ и ХбА1ц.
У двогодишњем двоструко слепом истраживању, старији пацијенти (стари од 59 до 89 година) са половином максималне сулфонилуреје (глипизид 10 мг два пута дневно) рандомизовани су на додавање АВАНДИА (н = 115, 4 мг једном дневно до 8 мг према потреби) или наставак повишене титрације глипизида (н = 110), до највише 20 мг два пута дневно. Средња основна вриједност ФПГ и ХбА1ц била је 157 мг / дЛ и 7,72%, за руку АВАНДИА плус глипизид, односно 159 мг / дЛ и 7,65%, за руку за титрацију глипизида, респективно. Губитак контроле гликемије (ФПГ - 180 мг / дЛ) догодио се код значајно нижег дележа пацијената (2%) на АВАНДИА плус глипизид у поређењу са пацијентима у руци за титрацију глипизида (28,7%). Око 78% пацијената на комбинованој терапији завршило је две године терапије, док је само 51% завршило монотерапију глипизидом. Учинак комбиноване терапије на ФПГ и ХбА1ц био је трајан током двогодишњег периода испитивања, код пацијената постизање средње вредности од 132 мг / дЛ за ФПГ и средње вредности 6,98% за ХбА1ц у поређењу са променама на глипизиду рука.
Комбинација са Сулфонилуреа Плус Метформином
У две, двоструко слепе, плацебо-контролисане студије од 24 до 26 недеља, намењене проценивању ефикасности и сигурности АВАНДИА у комбинацији са сулфонилурејом плус метформином, АВАНДИА 4 мг или 8 мг дневно, примењиван је у подељеним дозама два пута дневно, пацијентима који нису адекватно контролисани субмаксималним (10 мг) и максималним (20 мг) дозама глибурида и максималном дозом метформина (2 г / дан). Запажено је статистички значајно побољшање ФПГ и ХбА1ц код пацијената лечених комбинацијама сулфонилурее плус метформин и 4 мг АВАНДИА и 8 мг АВАНДИА у односу на болеснике наставили су са сулфонилуреом плус метформином, као што је приказано у табели 12.
Табела 12. Гликемијски параметри у 26-недељном комбинованом студију АВАНДИА Плус сулфонилуреје и метформина
| Сулфонилуреа + метформин Н = 273 |
АВАНДИА 2 мг два пута дневно + сулфонилуреа + метформин Н = 276 |
АВАНДИА 4 мг два пута дневно + сулфонилуреа + метформин Н = 277 |
|
| ФПГ (мг / дЛ) | |||
| Основна линија (средња вредност) | 189 | 190 | 192 |
| Промена од почетне (средње) | 14 | -19 | -40 |
| Разлика од сулфонилурее плус метформина (прилагођени просек) | - | -30* | -52* |
| % пацијената са ¥ мг 30 мг / дЛ смањује се од почетне вриједности | 16% | 46% | 62% |
| ХбА1ц (%) | |||
| Основна линија (средња вредност) | 8.7 | 8.6 | 8.7 |
| Промена од почетне (средње) | 0.2 | -0.4 | -0.9 |
| Разлика од сулфонилурее плус метформина (прилагођени просек) | - | -0.6* | -1.1* |
| % пацијената са 0,7% смањења од почетне вриједности | 16% | 39% | 63% |
| * п <0,0001 у поређењу са плацебом. |
врх
Референце
- Документ са брифом за храну и лекове. Заједнички састанак Саветодавних одбора за метаболизам ендокриноа и лекова за сигурност и управљање ризиком. Јуни 2007.
- ДРЕАМ истражни истражитељи. Утицај росиглитазона на учесталост дијабетеса код ослабљене толеранције на глукозу или ослабљене глукозе на глави: случајна контрола Ланцет 2006;368:1096-1105.
- Хоме ПД, Поцоцк СЈ, Бецк-Ниелсен Х и др. Росиглитазон је оцењен на резултате кардиоваскуларних болести - привремена анализа. НЕЈМ 2007; 357: 1-11.
- Парк ЈИ, Ким КА, Канг МХ и др. Утицај рифампина на фармакокинетику росиглитазона код здравих испитаника. Цлин Пхармацол Тхер 2004; 75: 157-162.
врх
Како се испоручује / складиштење и руковање
Свака петерокутна филмом обложена ТИЛТАБ таблета садржи росиглитазон као малеат, као што следи: 2 мг ружичасто, са утиснутим СБ са једне стране и 2 на другој; 4 мг наранџасте боје, утиснуто са СБ на једној страни и 4 на другој страни; 8 мг црвено-браон, деботирано са СБ на једној страни и 8 са друге стране.
- Боце од 2 мг од 60: НДЦ 0029-3158-18
- 4 мг боце од 30: НДЦ 0029-3159-13
- 4 мг боце од 90: НДЦ 0029-3159-00
- Боце од 8 мг од 30: НДЦ 0029-3160-13
- Боце од 8 мг од 90: НДЦ 0029-3160-59
Чувати на 25 ° Ц (77 ° Ф); излети 15 до 30 Ц (59 до 86 Ф). Распоредите у уској, отпорној на светлост посуду.
последњи пут ажурирано 02/2008
Авандиа, росиглитазон малеат, информације о пацијенту (на обичном енглеском)
Детаљне информације о знаковима, симптомима, узроцима, лечењу дијабетеса
Информације у овој монографији нису намијењене покривању свих могућих употреба, упута, мјера опреза, интеракције лијекова или штетних учинака. Ове информације су уопштене и нису замишљене као посебни медицински савети. Ако имате питања о лековима које узимате или желите више информација, обратите се свом лекару, фармацеуту или медицинској сестри.
назад на:Прегледајте све лекове за дијабетес

