Ацтос за дијабетес типа 2
Робна марка: Ацтос
Генеричко име: Пиоглитазоне Хидроцхлориде
Садржај:
Опис
Фармакологија
Индикације и употреба
Контраиндикације
Упозорења
Мере предострожности
Нежељене реакције
Предозирање
Дозирање и администрација
Како се испоручује
Ацтос, пиоглитазоне хцл, информације о пацијенту (на обичном енглеском)
УПОЗОРЕЊЕ: НЕПОКРЕТАК У СРЦУ
- Тиазолидиндиони, укључујући Ацтос, код неких пацијената изазивају или погоршавају конгестивно затајење срца (види УПОЗОРЕЊА). Након започињања Ацтоса и након повећања дозе, пажљиво посматрајте пацијенте због знакова и симптома срчане инсуфицијенције (укључујући прекомерно, брзо дебљање, диспнеју и / или едеме). Ако се ови знакови и симптоми развију, затајење срца треба управљати у складу са тренутним стандардима неге. Надаље, мора се размотрити прекид или смањење дозе лијека Ацтос.
- Ацтос се не препоручује пацијентима са симптоматском срчаном инсуфицијенцијом. Започињање Ацтос-а код пацијената са утврђеном срчаном инсуфицијенцијом НИХА класе ИИИ или ИВ је контраиндицирано (видети КОНТРАИНДИКАЦИЈЕ и УПОЗОРЕЊА).
Опис
Ацтос (пиоглитазон хидрохлорид) је орално антидијабетичко средство које делује пре свега смањењем инзулинске резистенције. Ацтос се користи у лечењу шећерне болести типа 2 (познате и као дијабетес мелитус неовисан од инсулина [НИДДМ] или дијабетес који настаје код одраслих). Фармаколошке студије показују да Ацтос побољшава осетљивост на инзулин у мишићном и масном ткиву и инхибира хепатичку глуконеогенезу. Ацтос побољшава контролу гликемије уз смањење нивоа инзулина у циркулацији.
Пиоглитазон [(±) -5 - [[4- [2- (5-етил-2-пиридинил) етокси] фенил] метил] -2,4-] тиазолидиндион монохидроклорид припада а различите хемијске класе и има различита фармаколошка дејства од сулфонилуреје, метформина или И--глукозидазе инхибитори. Молекул садржи један асиметрични угљеник, а једињење се синтетише и користи као рацемска смеша. Два енантиомера пиоглитазона међусобно се претварају ин виво. Нису пронађене разлике у фармаколошкој активности између два енантиомера. Структурна формула је приказана:
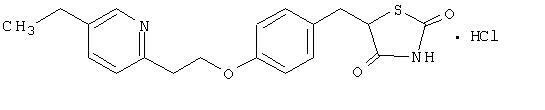
Пиоглитазон хидрохлорид је бели кристални прах без мириса који има молекуларну формулу Ц19Х20Н2О3С-ХЦл и молекулска маса 392,90 далтона. Растворљив је у Н, Н-диметилформамиду, мало растворљив у безводном етанолу, веома мало растворљив у ацетону и ацетонитрилу, практично нерастворљив у води и нерастворљив у етру.
Ацтос је доступан у облику таблета за оралну примену, који садржи 15 мг, 30 мг или 45 мг пиоглитазона (као базе) формулисаног са следећи помоћни састојци: лАктоза монохидрат НФ, хидроксипропилцелулоза НФ, карбоксиметилцелулоза калцијум НФ и магнезијум стеарат НФ.
врх
Клиничка фармакологија
Механизам дејства
Ацтос је тиазолидиндионски антидијабетички агенс који зависи од присуства инсулина због његовог механизма деловања. Ацтос смањује инзулинску резистенцију на периферији и у јетри што резултира повећаним одлагањем глукозе инзулином и смањеним лучењем глукозе у јетри. За разлику од сулфонилуреје, пиоглитазон није секретагог инсулина. Пиоглитазон је моћан агонист за пероксисом пролиферацијски активирани рецептор-гама (ППАР3). ППАР рецептори се налазе у ткивима важним за деловање инсулина, као што су масно ткиво, скелетни мишићи и јетра. Активација нуклеарних рецептора ППАРИ³ модулира транскрипцију бројних гена који реагују на инзулин који су укључени у контролу метаболизма глукозе и липида.
У животињским моделима дијабетеса, пиоглитазон смањује хипергликемију, хиперинзулинемију и хипертриглицеридемију карактеристичну за инсулинско резистентна стања, као што је дијабетес типа 2. Метаболичке промене изазване пиоглитазоном резултирају повећаном реакцијом ткива зависних од инсулина и примећене су у бројним животињским моделима отпорности на инзулин.
Пошто пиоглитазон појачава ефекте инсулина у циркулацији (смањујући отпорност на инзулин), он не снижава глукозу у крви код животињских модела којима недостаје ендогени инсулин.
Фармакокинетика и метаболизам лекова
Серумске концентрације укупног пиоглитазона (пиоглитазон плус активни метаболити) остају повишене 24 сата након дозирања једном дневно. Серумске концентрације пиоглитазона у стабилном стању и укупног пиоглитазона постигнуте су у року од 7 дана. У стању равнотеже, два фармаколошки активна метаболита пиоглитазона, Метаболитес ИИИ (М-ИИИ) и ИВ (М-ИВ), достижу концентрације у серуму једнаке или веће од пиоглитазона. И код здравих добровољаца и код пацијената са дијабетесом типа 2, пиоглитазон садржи отприлике 30% до 50% максималне укупне концентрације пиоглитазона у серуму и 20% до 25% укупне површине испод кривуље концентрације у времену серума (АУЦ).
Максимална концентрација у серуму (Ц)мак), АУЦ и најниже концентрације у серуму (Цмин) и за пиоглитазон и за укупни пиоглитазон пропорционално се повећавају у дозама од 15 мг и 30 мг дневно. Постоји нешто мање од пропорционалног повећања за пиоглитазон и укупни пиоглитазон у дози од 60 мг дневно.
Апсорпција: Након оралне примене, пиоглитазон се најпре измери у серуму у року од 30 минута, а највеће концентрације примећене су у року од 2 сата. Храна мало одлаже време до вршне концентрације у серуму на 3 до 4 сата, али не мења степен апсорпције.
Дистрибуција: Средња привидна запремина дистрибуције (Вд / Ф) пиоглитазона након примене једнократне дозе је 0,63 ± 0,41 (средња ± СД) Л / кг телесне масе.
Пиоглитазон се увелико везује за протеин (> 99%) у људском серуму, углавном за албумин у серуму. Пиоглитазон се такође везује за остале серумске протеине, али са нижим афинитетом. Метаболити М-ИИИ и М-ИВ су такође у великој вези (> 98%) са серумским албумином.
Метаболизам: Пиоглитазон се метаболизује у великој мери хидроксилацијом и оксидацијом; метаболити се такође делимично претварају у глукуронидне или сулфатне коњугате. Метаболити М-ИИ и М-ИВ (хидрокси деривати пиоглитазона) и М-ИИИ (кето дериват пиоглитазона) фармаколошки су активни на животињским моделима дијабетеса типа 2. Поред пиоглитазона, М-ИИИ и М-ИВ су главне врсте лека које се налазе у људском серуму након вишеструког дозирања. У стабилном стању, пиоглитазон, код здравих добровољаца и код пацијената са дијабетесом типа 2 садржи отприлике 30% до 50% укупних вршних концентрација у серуму и 20% до 25% укупни АУЦ.
Подаци ин витро показују да је више ЦИП изоформ укључено у метаболизам пиоглитазона. Укључени изоформи цитокрома П450 су ЦИП2Ц8 и, у мањој мери, ЦИП3А4 са додатним доприносом разних других изоформи, укључујући углавном екстрахепатички ЦИП1А1. Ин виво спроведене су студије пиоглитазона у комбинацији са инхибиторима П450 и супстратима (види Интеракције са лековима). Омјер урина 6А 6-хидроксикортизола / кортизола измерен код пацијената лечених Ацтосом показао је да пиоглитазон није јак индуктор ЦИП3А4 ензима.
Излучивање и елиминација: Након оралне примене, отприлике 15% до 30% дозе пиоглитазона извлачи се у урину. Бубрежна елиминација пиоглитазона је занемарљива, а лек се излучује првенствено као метаболити и њихови коњугати. Претпоставља се да се највећи део оралне дозе излучује у жуч било непромењено или као метаболити и елиминише се из измета.
Средњи полу-живот серума пиоглитазона и укупног пиоглитазона креће се од 3 до 7 сати и 16 до 24 сата. Пиоглитазон има очигледан зазор, ЦЛ / Ф, рачунато на 5 до 7 Л / хр.
Посебне популације
Бубрежна инсуфицијенција: Полуживот елиминације из пиоглитазона, М-ИИИ и М-ИВ у серуму остаје непромењен код пацијената са умереном (клиренс креатинина 30 до 60 мЛ / мин) до тешког (клиренс креатинина <30 мЛ / мин) оштећења бубрега у поређењу са нормалним субјекти. Не препоручује се прилагођавање дозе код пацијената са бубрежном дисфункцијом (види ДОЗИРАЊЕ И АДМИНИСТРАЦИЈА).
Хепатичка инсуфицијенција: У поређењу са нормалним контролама, испитаници са оштећеном функцијом јетре (Цхилд-Пугх степен Б / Ц) имају приближно 45% -тно смањење пиоглитазона и укупне максималне концентрације пиоглитазона, али нема промене средње АУЦ вредности.
Ацтос терапија се не сме започети ако пацијент покаже клиничке доказе активне болести јетре или нивоа трансаминазе у серуму (АЛТ) пређу 2,5 пута више од горње границе нормале (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Јетрени ефекти).
Старије особе: Код здравих старијих особа највеће серумске концентрације пиоглитазона и укупног пиоглитазона нису значајно различите, али вредности АУЦ-а су нешто више, а вредности терминалног полуживота нешто дуже него за млађи предмети. Те промене нису биле у величини која би се сматрала клинички релевантном.
Педијатрија: Фармакокинетички подаци у педијатријској популацији нису доступни.
Пол: средња вредност Цмак и вредности АУЦ код жена су порасле за 20% до 60%. Као монотерапија и у комбинацији са сулфонилурејом, метформином или инсулином, Ацтос је побољшао контролу гликемије и код мушкараца и код жена. У контролисаним клиничким испитивањима, хемоглобин А1ц (ХбА1ц) смањења од почетне вриједности била су углавном већа за жене него за мушкарце (просечна средња разлика у ХбА)1ц 0.5%). С обзиром да се терапија треба индивидуализовати за сваког пацијента како би се постигла контрола гликемије, не препоручује се прилагођавање дозе на основу самог пола.
Етничка припадност: Фармакокинетички подаци међу различитим етничким групама нису доступни.
Интеракције љекова и дрога
Следећи лекови су проучавани код здравих добровољаца који су користили Ацтос 45 мг једном дневно. Доље су наведени резултати:
Орални контрацептиви: Истодобна примена Ацтоса (45 мг једном дневно) и оралног контрацептива (1 мг норетиндрона плус 0,035 мг етинил естрадиола једном дневно) током 21 дана, резултирало је падом АУЦ етини естрадиола (0-24х) за 11% и 11-14% и Цмак редом. Није било значајних промена у АУЦ норетиндрона (0-24х) и Цмак. С обзиром на велику варијабилност фармакокинетике етинил естрадиола, клинички значај овог налаза није познат.
Фексофенадин ХЦл: Истодобна примена Ацтоса током 7 дана са 60 мг фексофенадина који се даје орално два пута дневно, није резултирала значајним ефектом на фармакокинетику пиоглитазона. Ацтос није имао значајног утицаја на фармакокинетику фексофенадина.
Глипизид: Истодобна примена Ацтоса и 5 мг глипизида, која се даје орално једном дневно током 7 дана, није променила фармакокинетику глипизида у стању стабилности.
Дигоксин: Истодобна примена Ацтоса са 0,25 мг дигоксина који се даје орално једном дневно током 7 дана није променила фармакокинетику дигоксина у стању стабилности.
Варфарин: Истодобна примена Ацтоса током 7 дана са варфарином није променила фармакокинетику варфарина у сталном стању. Ацтос нема клинички значајан утицај на протромбинско време када се примењује пацијентима који примају хроничну терапију варфарином.
Метформин: Истодобна примена једне дозе метформина (1000 мг) и Ацтоса после 7 дана Ацтоса није променила фармакокинетику појединачне дозе метформина.
Мидазолам: Примјена Ацтоса током 15 дана, праћена једном дозом од 7,5 мг мидазолам сирупа, резултирала је смањењем мидазолама Ц за 26%мак и АУЦ.
Ранитидин ХЦл: Истодобна примена Ацтоса током 7 дана са ранитидином који се даје орално два пута дневно током 4 или 7 дана није резултирала значајним ефектом на фармакокинетику пиоглитазона. Ацтос није показао значајан утицај на фармакокинетику ранитидина.
Нифедипин ЕР: Истодобна примена Ацтоса током 7 дана са 30 мг нифедипина ЕР орално једанпут дневно током 4 дана мушки и женски добровољци резултирали су најмање квадратним средњим вредностима (90% ЦИ) за непромењени нифедипин од 0,83 (0,73 - 0,95) за Цмак и 0,88 (0,80 - 0,96) за АУЦ. С обзиром на велику варијабилност фармакокинетике нифедипина, клинички значај овог налаза није познат.
Кетоконазол: Истодобна примена Ацтоса током 7 дана са кетоконазолом у одмеру 200 мг два пута дневно резултирало најмање квадратним средњим вредностима (90% ЦИ) за непромењени пиоглитазон од 1,14 (1,06 - 1,23) за Цмак, 1,34 (1,26 - 1,41) за АУЦ и 1,87 (1,71 - 2,04) за Цмин.
Аторвастатин калцијум: Истодобна примена Ацтоса током 7 дана са аторвастатин калцијумом (ЛИПИТОР®) 80 мг једном дневно резултира најмање квадратним средњим вредностима (90% ЦИ) за непромењени пиоглитазон од 0,69 (0,57 - 0,85) за Цмак0,76 (0,65 - 0,88) за АУЦ и 0,96 (0,87 - 1,05) за Цмин. За непромењени аторвастатин најмање квадратне средње вредности (90% ЦИ) су биле 0,77 (0,66 - 0,90) за Цмак0,86 (0,78 - 0,94) за АУЦ и 0,92 (0,82 - 1,02) за Цмин.
Теофилин: Истодобна примена Ацтоса током 7 дана са теофилином 400 мг примењеним два пута дневно није довела до промене фармакокинетике било ког лека.
Цитохром П450: Види МЕРЕ ПРЕДОСТРОЖНОСТИ
Гемфиброзил: Истодобна примена гемфиброзила (орално 600 мг два пута дневно), инхибитора ЦИП2Ц8, са пиоглитазоном (30 мг орално) код 10 здравих добровољаца који су претходно лечени 2 дана пре употребе гемфиброзила (орално 600 мг два пута дневно) резултирало је да је изложеност пиоглитазону (АУЦ0-24) 226% изложености пиоглитазону у одсуству гемфиброзила (види МЕРЕ ПРЕДОСТРОЖНОСТИ).
Рифампин: Истодобна примена рифампина (орално 600 мг једном дневно), индуктора ЦИП2Ц8 са пиоглитазоном (30 мг орално) у 10 здравих добровољци претходно лечени рифампином (орални 600 мг једном дневно) резултирали су смањењем АУЦ пиоглитазона за 54% (видети МЕРЕ ПРЕДОСТРОЖНОСТИ).
Фармакодинамика и клиничка дејства
Клиничке студије показују да Ацтос побољшава инзулинску осетљивост код пацијената отпорних на инсулин. Ацтос појачава ћелијску реакцију на инсулин, повећава одлагање глукозе у зависности од инсулина, побољшава осетљивост јетре на инзулин и побољшава дисфункционалну хомеостазу глукозе. Код пацијената са дијабетесом типа 2, смањена отпорност на инзулин произведена Ацтосом резултира нижим концентрацијама глукозе у плазми, нижим нивоима инсулина у плазми и нижим ХбА1ц вредности. На основу резултата отворене студије о продужењу, чини се да ефекти снижавања глукозе из Ацтоса остају најмање годину дана. У контролисаним клиничким испитивањима, Ацтос у комбинацији са сулфонилурејом, метформином или инсулином имао је адитиван утицај на контролу гликемије.
Пацијенти с поремећајима липида били су укључени у клиничка испитивања с Ацтос-ом. Све у свему, пацијенти лечени Ацтос-ом имали су средњи пад триглицерида, средњи пораст ХДЛ холестерола и нередовне средње промене ЛДЛ-а и укупног холестерола.
У 26-недељној, плацебо контролираној студији распона доза, средњи нивои триглицерида смањени су у дозираним групама од 15 мг, 30 мг и 45 мг Ацтос у поређењу са средњим порастом плацебо групе. Средњи нивои ХДЛ-а повећали су се у већој мери код пацијената лечених Ацтос-ом него код плацебо-лечених. Није било конзистентних разлика за ЛДЛ и укупни холестерол код пацијената лечених Ацтосом у поређењу са плацебом (Табела 1).
Табела 1 Липиди у 26-недељној плацебо-контролираној студији монотерапије под дозом распона
| Плацебо | Ацтос 15 мг Једном Свакодневно |
Ацтос 30 мг Једном Свакодневно |
Ацтос 45 мг Једном Свакодневно |
|
| Триглицериди (мг / дЛ) | Н = 79 | Н = 79 | Н = 84 | Н = 77 |
| Основна линија (средња вредност) | 262.8 | 283.8 | 261.1 | 259.7 |
| Процентуална промена од основне (средња) | 4.8% | -9.0% | -9.6% | -9.3% |
| ХДЛ холестерол (мг / дЛ) | Н = 79 | Н = 79 | Н = 83 | Н = 77 |
| Основна линија (средња вредност) | 41.7 | 40.4 | 40.8 | 40.7 |
| Процентуална промена од основне (средња) | 8.1% | 14.1% | 12.2% | 19.1% |
| ЛДЛ холестерол (мг / дЛ) | Н = 65 | Н = 63 | Н = 74 | Н = 62 |
| Основна линија (средња вредност) | 138.8 | 131.9 | 135.6 | 126.8 |
| Процентуална промена од основне (средња) | 4.8% | 7.2% | 5.2% | 6.0% |
| Укупни холестерол (мг / дЛ) | Н = 79 | Н = 79 | Н = 84 | Н = 77 |
| Основна линија (средња вредност) | 224.6 | 220.0 | 222.7 | 213.7 |
| Процентуална промена од основне (средња) | 4.4% | 4.6% | 3.3% | 6.4% |
У друге две студије монотерапије (24 недеље и 16 недеља) и у комбинованим студијама терапије са сулфонилурејом (24 недеље и 16 недеља) и метформин (24 недеље и 16 недеља), резултати су углавном били у складу са подацима горе. У испитивањима која су контролисана плацебом, просечне промене са плацебом коригиране од почетне вриједности смањиле су се за 5% до 26% за триглицериде и порасле од 6% до 13% за ХДЛ код пацијената лечених Ацтос-ом. Сличан образац резултата примећен је у 24-недељним студијама комбиноване терапије Ацтос-ом са сулфонилурејом или метформином.
У студији комбиноване терапије инсулином (16 недеља) такође је смањена просечна промена плацебо-корекције у односу на почетне вредности триглицерида код пацијената лечених Ацтос-ом. Примећена је плацебо-коригирана средња промена од нивоа основне вредности ЛДЛ холестерола од 7% за групу доза од 15 мг. Примећени су слични резултати као код оних који су горе наведени за ХДЛ и укупни холестерол. Сличан образац резултата примећен је у 24-недељној комбинованој терапији са Ацтос-ом са инсулином.
Клиничке студије
Монотерапија
У САД су спроведена три рандомизована, двоструко слепа, плацебо-контролисана испитивања у трајању од 16 до 26 недеља како би се проценила употреба Ацтоса као монотерапије код пацијената са дијабетесом типа 2. Ове студије испитивале су Ацтос у дозама до 45 мг или плацебо једном дневно код 865 пацијената.
У 26-недељном истраживању распона дозе, 408 пацијената са дијабетесом типа 2 рандомизовано је да примају 7,5 мг, 15 мг, 30 мг или 45 мг Ацтоса или плацебо једном дневно. Терапија било којим претходним антидијабетичким средством прекинута је 8 недеља пре двоструко слепог периода. Третман са 15 мг, 30 мг и 45 мг Ацтоса довео је до статистички значајних побољшања ХбА1ц и глукозе у плазми након поста (ФПГ) у крајњој тачки у поређењу са плацебом (Слика 1, Табела 2).
Слика 1 приказује временски ток промена ФПГ и ХбА1ц за целокупну популацију у овој 26-недељној студији.
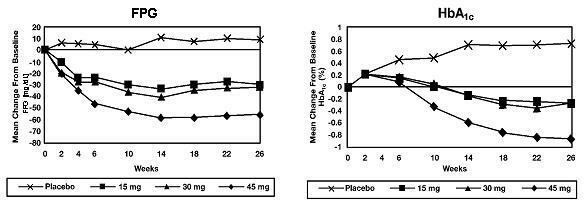
Табела 2 приказује ХбА1ц и ФПГ вредности за целу популацију студија.
Табела 2 Гликемијски параметри у 26-недељном плацебо-контролираном испитивању дозе
| Плацебо | Ацтос 15 мг Једном Свакодневно |
Ацтос 30 мг Једном Свакодневно |
Ацтос 45 мг Једном Свакодневно |
|
| ТОТАЛНА ПОПУЛАЦИЈА | ||||
| ХбА1ц (%) | Н = 79 | Н = 79 | Н = 85 | Н = 76 |
| Основна линија (средња вредност) | 10.4 | 10.2 | 10.2 | 10.3 |
| Промена од почетне (прилагођена средња вредност)+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Разлика од плацеба (прилагођена средња вредност)+) | -1.0* | -1.0* | -1.6* | |
| ФПГ (мг / дЛ) | Н = 79 | Н = 79 | Н = 84 | Н = 77 |
| Основна линија (средња вредност) | 268 | 267 | 269 | 276 |
| Промена од почетне (прилагођена средња вредност)+) | 9 | -30 | -32 | -56 |
| Разлика од плацеба (прилагођена средња вредност)+) | -39* | -41* | -65* | |
|
+ Прилагођен за основни, здружени центар и здружени центар интеракцијом лечења * п а € 0,050 вс. плацебо |
Испитна популација обухватала је пацијенте који претходно нису лечени антидијабетичким лековима (наиве; 31%) и пацијенти који су примали антидијабетичке лекове у време уписа у студију (претходно лечени; 69%). Подаци за напс и претходно лечене подскупове пацијената приказани су у Табели 3. Сви пацијенти су ушли у 8-недељни период испирања / излучивања пре двоструко слепог лечења. Овај период покретања био је повезан са малим променама ХбА1ц и ФПГ вредности од скрининга до почетног нивоа за на пацијенте; међутим, за претходно лечену групу, испирање из претходних антидијабетичких лекова резултирало је погоршањем контроле гликемије и повећањем ХбА1ц и ФПГ. Иако је већина пацијената у групи која је претходно лечена имала смањење ХбА од почетне1ц и ФПГ са Ацтос-ом, у многим случајевима вредности се нису вратиле на нивое скрининга до краја студије. Дизајн студије није дозволио процену пацијената који су директно прешли на Ацтос са другог антидијабетичког средства.
Табела 3 Гликемијски параметри у 26-недељном плацебо-контролираном испитивању дозе
| Плацебо | Ацтос 15 мг Једном Свакодневно |
Ацтос 30 мг Једном Свакодневно |
Ацтос 45 мг Једном Свакодневно |
|
| НаА¡ве то терапији ХбА1ц (%) |
Н = 25 | Н = 26 | Н = 26 | Н = 21 |
| Сцреенинг (средња вредност) | 9.3 | 10.0 | 9.5 | 9.8 |
| Основна линија (средња вредност) | 9.0 | 9.9 | 9.3 | 10.0 |
| Промена од основне (прилагођена средња вредност *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Разлика од плацеба (прилагођени просек *) | -1.4 | -1.3 | -2.6 | |
| ФПГ (мг / дЛ) | Н = 25 | Н = 26 | Н = 26 | Н = 21 |
| Сцреенинг (средња вредност) | 223 | 245 | 239 | 239 |
| Основна линија (средња вредност) | 229 | 251 | 225 | 235 |
| Промена од основне (прилагођена средња вредност *) | 16 | -37 | -41 | -64 |
| Разлика од плацеба (прилагођени просек *) | -52 | -56 | -80 | |
| Претходно лечено ХбА1ц (%) |
Н = 54 | Н = 53 | Н = 59 | Н = 55 |
| Сцреенинг (средња вредност) | 9.3 | 9.0 | 9.1 | 9.0 |
| Основна линија (средња вредност) | 10.9 | 10.4 | 10.4 | 10.6 |
| Промена од основне (прилагођена средња вредност *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Разлика од плацеба (прилагођени просек *) | -1.0 | -0.9 | -1.4 | |
| ФПГ (мг / дЛ) | Н = 54 | Н = 53 | Н = 58 | Н = 56 |
| Сцреенинг (средња вредност) | 222 | 209 | 230 | 215 |
| Основна линија (средња вредност) | 285 | 275 | 286 | 292 |
| Промена од основне (прилагођена средња вредност *) | 4 | -32 | -27 | -55 |
| Разлика од плацеба (прилагођени просек *) | -36 | -31 | -59 | |
| * Прилагођено основној линији и обједињеном центру |
У 24-недељној, плацебо-контролираној студији, 260 пацијената са дијабетесом типа 2 рандомизовано је у једну од две групе за терапију Ацтос-ом са присилном титрацијом или с ручном титрацијом плацебо групе. Терапија било којим претходним антидијабетичким средством прекинута је 6 недеља пре двоструко слепог периода. У једној групи за лечење Ацтос-ом пацијенти су примали почетну дозу од 7,5 мг једном дневно. После четири недеље, доза је повећана на 15 мг једном дневно, а након још четири недеље доза је повећана на 30 мг једном дневно током остатка студије (16 недеља). У другој групи за лечење Ацтос-ом, пацијенти су примали почетну дозу од 15 мг једном дневно и титрирали су се на 30 мг једном дневно и 45 мг једном дневно на сличан начин. Лечење Ацтос-ом, као што је описано, довело је до статистички значајних побољшања ХбА1ц и ФПГ у крајњој тачки у поређењу са плацебом (Табела 4).
Табела 4 Гликемијски параметри у 24-недељном плацебо-контролираном испитивању присилне титрације
| Плацебо | Ацтос 30 мг+ Једном дневно |
Ацтос 45 мг+ Једном дневно |
|
| Тотална популација ХбА1ц (%) |
Н = 83 | Н = 85 | Н = 85 |
| Основна линија (средња вредност) | 10.8 | 10.3 | 10.8 |
| Промена од почетне (прилагођена средња вредност)++) | 0.9 | -0.6 | -0.6 |
| Разлика од плацеба (прилагођена средња вредност)++) | -1.5* | -1.5* | |
| ФПГ (мг / дЛ) | Н = 78 | Н = 82 | Н = 85 |
| Основна линија (средња вредност) | 279 | 268 | 281 |
| Промена од почетне (прилагођена средња вредност)++) | 18 | -44 | -50 |
| Разлика од плацеба (прилагођена средња вредност)++) | -62* | -68* | |
|
+ Коначна доза у присилној титрацији ++ Прилагођен за основни, здружени центар и здружени центар интеракцијом лечења * п а € 0,050 вс. плацебо |
За пацијенте који претходно нису лечени антидијабетичким лековима (24%), средње вредности при прегледу су биле 10,1% за ХбА1ц и 238 мг / дЛ за ФПГ. На почетку, средња вредност ХбА1ц био је 10,2%, а средња вредност ФПГ била је 243 мг / дЛ. У поређењу са плацебом, лечење Ацтос-ом титрираним на крајњу дозу од 30 мг и 45 мг резултирало је смањењем просечне вредности ХбА од почетне1ц од 2,3% и 2,6%, а средња вредност ФПГ од 63 мг / дЛ, односно 95 мг / дЛ, респективно. За пацијенте који су претходно лечени антидијабетичким лековима (76%), овај лек је обустављен приликом прегледа. Средње вредности при прегледу су биле 9,4% за ХбА1ц и 216 мг / дЛ за ФПГ. На почетку, средња вредност ХбА1ц био је 10,7%, а средња вредност ФПГ била је 290 мг / дЛ. У поређењу са плацебом, лечење Ацтос-ом титрираним на крајњу дозу од 30 мг и 45 мг резултирало је смањењем просечне вредности ХбА од почетне1ц од 1,3% и 1,4% и средњи ФПГ од 55 мг / дЛ, односно 60 мг / дл, респективно. За многе претходно лечене ХбА1ц и ФПГ се нису вратили на нивое скрининга до краја студије.
У 16-недељној студији, 197 пацијената са дијабетесом типа 2 били су насумично подвргнути третману са 30 мг Ацтоса или плацебом једном дневно. Терапија било којим претходним антидијабетичким средством прекинута је 6 недеља пре двоструко слепог периода. Третман са 30 мг Ацтоса довео је до статистички значајних побољшања ХбА1ц и ФПГ у крајњој тачки у поређењу са плацебом (Табела 5).
Табела 5 Гликемијски параметри у 16-недељној плацебо-контролираној студији
| Плацебо | Ацтос 30 мг Једном дневно |
|
| Тотална популација ХбА1ц (%) |
Н = 93 | Н = 100 |
| Основна линија (средња вредност) | 10.3 | 10.5 |
| Промена од почетне (прилагођена средња вредност)+) | 0.8 | -0.6 |
| Разлика од плацеба (прилагођена средња вредност)+) | -1.4* | |
| ФПГ (мг / дЛ) | Н = 91 | Н = 99 |
| Основна линија (средња вредност) | 270 | 273 |
| Промена од почетне (прилагођена средња вредност)+) | 8 | -50 |
| Разлика од плацеба (прилагођена средња вредност)+) | -58* | |
|
+ Прилагођен за основни, здружени центар и здружени центар интеракцијом лечења * п а € 0,050 вс. плацебо |
За пацијенте који раније нису лечени антидијабетичким лековима (40%), средње вредности при прегледу су биле 10,3% за ХбА1ц и 240 мг / дЛ за ФПГ. На почетку, средња вредност ХбА1ц био 10,4%, а средња вредност ФПГ била је 254 мг / дЛ. У поређењу са плацебом, лечење Ацтос-ом 30 мг резултирало је смањењем почетног нивоа у средњем ХбА1ц од 1,0% и средњи ФПГ од 62 мг / дЛ. За пацијенте који су претходно лечени антидијабетичким лековима (60%), овај лек је обустављен приликом прегледа. Средње вредности при прегледу су биле 9,4% за ХбА1ц и 216 мг / дЛ за ФПГ. На почетку, средња вредност ХбА1ц био 10,6%, а средња вредност ФПГ била је 287 мг / дЛ. У поређењу са плацебом, лечење Ацтос-ом 30 мг резултирало је смањењем почетног нивоа у средњем ХбА1ц од 1,3% и средњи ФПГ од 46 мг / дЛ. За многе претходно лечене ХбА1ц и ФПГ се нису вратили на нивое скрининга до краја студије.
Комбинована терапија
Три 16-недељне, рандомизоване, двоструко слепе, плацебо контролисане клиничке студије и три 24-недељне, рандомизоване, двоструко слепе, са дозом контролисане спроведене су клиничке студије за процену ефеката Ацтоса на контролу гликемије код пацијената са дијабетесом типа 2 који су били неадекватно контролисан (ХбА)1ц ‰ ¥ 8%) упркос тренутној терапији сулфонилурејом, метформином или инсулином. Претходни третман дијабетеса можда је био монотерапија или комбинирана терапија.
Студије Ацтос Плус сулфонилурее
Обављена су два клиничка испитивања са Ацтос-ом у комбинацији са сулфонилурејом. Обе студије укључују пацијенте са дијабетесом типа 2 на сулфонилуреју, самостално или у комбинацији са другим антидијабетичким средством. Сва друга антидијабетичка средства повучена су пре почетка лечења у испитивању. У првој студији, 560 пацијената је насумично примљено 15 мг или 30 мг Ацтоса или плацеба једном дневно током 16 недеља поред њиховог тренутног режима сулфонилурее. У поређењу са плацебом у 16. недељи, додавање Ацтоса сулфонилуреји значајно је смањило средњу вредност ХбА1ц за 0,9% и 1,3%, а средња вредност ФПГ за 39 мг / дЛ и 58 мг / дЛ за дозе од 15 мг и 30 мг, респективно.
У другој студији, 702 пацијента су рандомизирана да су примили 30 мг или 45 мг Ацтоса једном дневно током 24 недеље уз њихов тренутни режим сулфонилурее. Средња смањења од почетног нивоа у 24. недељи у ХбА1ц били су 1,55% и 1,67% за дозе од 30 мг и 45 мг, респективно. Средња смањења од почетне вредности ФПГ била су 51,5 мг / дЛ и 56,1 мг / дЛ.
Терапеутски ефекат Ацтоса у комбинацији са сулфонилурејом примећен је код пацијената без обзира да ли су пацијенти примали ниске, средње или високе дозе сулфонилуреје.
Студије метформина Ацтос Плус
Две клиничке студије су спроведене са Ацтос-ом у комбинацији са метформином. Обе студије укључују пацијенте са дијабетесом типа 2 на метформину, самостално или у комбинацији са другим антидијабетичким средством. Сва друга антидијабетичка средства повучена су пре почетка лечења у испитивању. У првој студији, 328 пацијената је насумично примљено или узимало 30 мг Ацтоса или плацебо једном дневно, током 16 недеља, поред тренутног режима метформина. У поређењу са плацебом у 16. недељи, додавање Ацтос-а метформину значајно је смањило средњу вредност ХбА1ц за 0,8% и смањио је средњи ФПГ за 38 мг / дЛ.
У другој студији, 827 пацијената је насумично одабрано да примају 30 мг или 45 мг Ацтоса једном дневно током 24 недеље, поред тренутног режима метформина. Средња смањења од почетног нивоа у 24. недељи у ХбА1ц били су 0,80% и 1,01% за дозе од 30 мг и 45 мг, респективно. Средња смањења од почетне вредности ФПГ била су 38,2 мг / дЛ и 50,7 мг / дЛ.
Терапеутски ефекат Ацтос-а у комбинацији са метформином примећен је код пацијената без обзира да ли су пацијенти примали ниже или веће дозе метформина.
Студије инсулина Ацтос Плус
Обављена су два клиничка испитивања са Ацтос-ом у комбинацији са инсулином. Обе студије су укључивале пацијенте са дијабетесом типа 2 на инсулину, самостално или у комбинацији са другим антидијабетичким средством. Сва друга антидијабетичка средства повучена су пре почетка лечења у испитивању. У првој студији, рандомизирано је 566 пацијената који су примали медијан од 60,5 јединица на дан инсулина примати или 15 мг или 30 мг Ацтоса или плацебо једном дневно током 16 недеља поред свог инсулина режим. У поређењу са плацебом у 16. недељи, додавање Ацтоса инсулину значајно је смањило оба ХбА1ц за 0,7% и 1,0% и ФПГ за 35 мг / дЛ и 49 мг / дЛ за дозу од 15 мг и 30 мг, респективно.
У другој студији, 690 пацијената који су примали медијун инзулина од 60,0 дневно, примали су 30 мг или 45 мг Ацтоса једном дневно током 24 недеље поред свог тренутног режима инсулина. Средња смањења од почетног нивоа у 24. недељи у ХбА1ц били су 1,17% и 1,46% за дозе од 30 мг и 45 мг, респективно. Средња смањења од почетне вредности ФПГ била су 31,9 мг / дЛ и 45,8 мг / дЛ. Побољшана контрола гликемије праћена је средњим падом од почетне вриједности у захтевима за дозу инзулина од 6,0% и 9,4% дневно за дозу од 30 мг и 45 мг.
Терапеутски ефекат Ацтоса у комбинацији са инсулином примећен је код пацијената без обзира да ли су пацијенти примали ниже или веће дозе инсулина.
врх
Индикације и употреба
Ацтос је индициран као додатак исхрани и вежбању ради побољшања контроле гликемије код одраслих са шећерном болешћу типа 2.
врх
Контраиндикације
Започињање Ацтос-а код пацијената са утврђеном срчаном инсуфицијенцијом Нев Иорк Невса (НИХА) класе ИИИ или ИВ је контраиндицирано (видети БОКСЕД УПОЗОРЕЊЕ).
Ацтос је контраиндициран код пацијената са познатом преосетљивошћу на овај производ или било коју од његових компоненти.
врх
Упозорења
Затајивање срца и остали кардиолошки ефекти
Ацтос, као и други тиазолидиндиони, може изазвати задржавање течности када се користи сам или у комбинацији са другим антидијабетичким агенсима, укључујући инзулин. Задржавање течности може довести до или погоршати затајење срца. Пацијенте треба посматрати због знакова и симптома срчане инсуфицијенције. Ако се ови знакови и симптоми развију, затајење срца треба управљати у складу са тренутним стандардима неге. Надаље, мора се размотрити прекид или смањење дозе Ацтос (види БОКСЕД УПОЗОРЕЊЕ). Пацијенти са срчаним статусом НИХА класе ИИИ и ИВ нису проучавани током клиничких испитивања пре одобравања, а Ацтос се не препоручује код ових болесника (видети БОКСЕД УПОЗОРЕЊЕ и КОНТРАИНДИКАЦИЈЕ).
У једном 16-недељном америчком двоструко слепом, плацебо-контролисаном клиничком испитивању у коме је учествовало 566 пацијената са типом 2 дијабетес, Ацтос у дозама од 15 мг и 30 мг у комбинацији са инсулином је упоређен са терапијом инсулином сама. Ово испитивање је укључивало пацијенте са дугогодишњом дијабетесом и великом преваленцијом постојећих здравствених стања, како следи: артеријска хипертензија (57,2%), периферна неуропатија (22,6%), коронарна болест срца (19,6%), ретинопатија (13,1%), миокардијал инфаркт (8,8%), васкуларна болест (6,4%), ангина пекторис (4,4%), мождани удар и / или пролазни исхемијски напад (4,1%), и конгестивни затајење срца (2,3%).
У овој студији, два од 191 пацијента који су примали 15 мг Ацтос плус инсулин (1,1%) и два од 188 пацијената који су примали 30 мг Ацтос плус инзулин (1,1%) развио је конгестивну срчану инсуфицијенцију у поређењу са ниједним од 187 пацијената на терапији инсулином. Сва четворо ових пацијената имало је историју кардиоваскуларних стања, укључујући коронарну болест артерија, претходне ЦАБГ процедуре и инфаркт миокарда. У 24-недељној студији под надзором дозе у којој је Ацтос истовремено примењен инсулин, 0,3% пацијената (1/345) на 30 мг и 0,9% (3/345) пацијената на 45 мг пријавило је ЦХФ као озбиљан нежељени догађај .
Анализа података из ових студија није идентификовала специфичне факторе који предвиђају повећани ризик од конгестивног затајења срца на комбинованој терапији инсулином.
Код дијабетеса типа 2 и конгестивног затајења срца (систоличка дисфункција)
Извршена је 24-недељна студија испитивања сигурности како би се упоредио Ацтос (н = 262) са глибуридом (н = 256) код неконтролисаних дијабетичара (средња вредност ХбА1ц 8,8% у почетној фази) са НИХА класа ИИ и ИИИ срчане инсуфицијенције и фракције избацивања мањом од 40% (средња вредност ЕФ 30% у почетној вредности). Током студије пријављено је преконоћно хоспитализација због конгестивне срчане инсуфицијенције у 9,9% пацијенти на Ацтос-у у поређењу са 4,7% болесника који су примали глибурид са разликом у лечењу од 6 седмица. Овај нежељени догађај повезан са Ацтосом био је израженији код пацијената који су инзулин користили у почетној фази и код пацијената старијих од 64 године. Није примећена разлика у смртности од кардиоваскуларног система између група лечења.
Ацтос треба започети у најнижој одобреној дози ако је прописана пацијентима са дијабетесом типа 2 и систоличком срчаном инсуфицијенцијом (класа ИИ НИХА). Ако је потребно наредно ескалирање дозе, дозу треба постепено повећавати тек након неколико месеци лечења уз пажљиво праћење дебљања, едема или знакова и симптома ЦХФ погоршање.
Проспективно клиничко испитивање пиоглитазона у макроваскуларним догађајима (проактивно)
У ПРОАктиву, 5238 пацијената са дијабетесом типа 2 и ранијом макроваскуларном болешћу претходно су лечени Ацтосом (н = 2605), титрованим силом до 45 мг једном дневно, или плацебом (н = 2633) (видети НЕЖЕЉЕНЕ РЕАКЦИЈЕ). Проценат пацијената који су имали озбиљну срчану инсуфицијенцију био је већи за пацијенте лечене Ацтосом (5,7%, н = 149) него за болеснике лечене плацебом (4,1%, н = 108). Учесталост смрти након извештаја о озбиљној срчаној инсуфицијенцији била је 1,5% (н = 40) код пацијената лечених Ацтос-ом и 1,4% (н = 37) код пацијената који су лечили плацебо. У болесника који су на почетку лечени режимом који садржи инсулин, учесталост озбиљне срчане инсуфицијенције била је 6,3% (н = 54/864) са Ацтос-ом и 5,2% (н = 47/896) са плацебом. За оне пацијенте који су у почетку лечени режимом који садржи сулфонилуреју, учесталост озбиљне срчане инсуфицијенције била је 5,8% (н = 94/1624) са Ацтос-ом и 4,4% (н = 71/1626) код плацеба.
врх
Мере предострожности
Генерал
Ацтос показује своје антихипергликемијско дејство само у присуству инсулина. Због тога се Ацтос не сме користити код пацијената са дијабетесом типа 1 или за лечење дијабетичке кетоацидозе.
Хипогликемија: Пацијенти који примају Ацтос у комбинацији са инсулином или оралним хипогликемијским агенсима могу бити изложени ризику од хипогликемије, па ће можда бити потребно и смањење дозе пратећег агенса.
Кардиоваскуларни: У америчким плацебо контролираним клиничким испитивањима која су искључила болеснике са Њујоршким срчаним удружењем (НИХА) класе ИИИ и ИВ кардиолошког статуса, учесталост озбиљни срчани нежељени догађаји повезани са експанзијом волумена нису повећани код пацијената лечених Ацтос-ом као монотерапија или у комбинацији са сулфонилуреама или метформином вс. пацијенте који су лечени плацебом. У студијама комбинације инсулина, мали број пацијената са историјом раније постојао срчана болест развила конгестивно затајење срца када се лечи Ацтос-ом у комбинацији са инсулином (види УПОЗОРЕЊА). Пацијенти са срчаним статусом НИХА класе ИИИ и ИВ нису испитивани у овим клиничким испитивањима Ацтос. Ацтос није индициран код пацијената са срчаним статусом класе ИИИ или ИВ од НИХА.
У постмаркетиншком искуству са Ацтосом, забележени су случајеви конгестивног затајења срца код пацијената са и без раније познатих срчаних болести.
Едем: Ацтос треба користити са опрезом код пацијената са едемом. У свим америчким клиничким испитивањима пријављен је едем чешће код пацијената лечених Ацтосом него код пацијената који су лечили плацебо и чини се да су они повезани са дозом (види НЕЖЕЉЕНЕ РЕАКЦИЈЕ). У искуству постмаркетинга, примљени су извјештаји о покретању или погоршању едема. Будући да тиазолидиндиони, укључујући Ацтос, могу изазвати задржавање течности, што може погоршати или довести до конгестивне срчане инсуфицијенције, Ацтос треба користити са опрезом код пацијената који су у ризику од затајења срца. Пацијенте треба надгледати због знакова и симптома срчане инсуфицијенције (види БОКСЕД УПОЗОРЕЊЕ, УПОЗОРЕЊА, и МЕРЕ ПРЕДОСТРОЖНОСТИ).
Повећање телесне тежине: Повећање телесне тежине повезано је са само Ацтос-ом и у комбинацији са другим хипогликемијским агенсима (Табела 6). Механизам дебљања је нејасан, али вероватно укључује комбинацију задржавања течности и накупљања масти.
Табела 6 Промене тежине (кг) од основне вредности током двоструко слепих клиничких испитивања са ацтос-ом
| Контролна група (Плацебо) |
Ацтос 15 мг |
Ацтос 30 мг |
Ацтос 45 мг |
||
| Медијан (25тх/75тх пертилетил) |
Медијан (25тх/75тх пертилетил) |
Медијан (25тх/75тх пертилетил) |
Медијан (25тх/75тх пертилетил) |
||
| Монотерапија | -1.4 (-2.7/0.0) н = 256 |
0.9(-0.5/3.4) н = 79 |
1.0(-0.9/3.4) н = 188 |
2.6 (0.2/5.4) н = 79 |
|
| Комбинована терапија | Сулфонилуреа | -0.5 (-1.8/0.7) н = 187 |
2.0 (0.2/3.2) н = 183 |
3.1 (1.1/5.4) н = 528 |
4.1 (1.8/7.3) н = 333 |
| Метформин | -1.4 (-3.2/0.3) н = 160 |
Н / А | 0.9(-0.3/3.2) н = 567 |
1.8(-0.9/5.0) н = 407 |
|
| Инсулин | 0.2 (-1.4/1.4) н = 182 |
2.3 (0.5/4.3) н = 190 |
3.3 (0.9/6.3) н = 522 |
4.1 (1.4/6.8) н = 338 |
|
| Напомена: Пробно трајање од 16 до 26 недеља |
Овулација: Терапија Ацтос-ом, као и други тиазолидиндиони, може резултирати овулацијом код неких пременопаузалних ановулаторних жена. Као резултат, ове пацијенткиње могу имати повећан ризик за трудноћу док узимају Ацтос. Стога би требало препоручити адекватну контрацепцију код жена у пременопаузи. Овај могући ефекат није испитиван у клиничким студијама, па учесталост ове појаве није позната.
Хематолошки: Ацтос може узроковати смањење хемоглобина и хематокрита. У свим клиничким студијама, просечне вредности хемоглобина опале су за 2% до 4% код пацијената лечених Ацтос-ом. Ове промене су се првенствено десиле током првих 4 до 12 недеља терапије и после тога су остале релативно константне. Ове промене могу бити повезане са повећаном запремином плазме и ретко су повезане са било којим значајним хематолошким клиничким ефектима (види НЕЖЕЉЕНЕ РЕАКЦИЈЕ, Лабораторијске неправилности).
Јетрени ефекти: У клиничким студијама пре одобравања широм света, преко 4500 испитаника лечено је Ацтос-ом. У америчким клиничким студијама преко 4700 пацијената са дијабетесом типа 2 примило је Ацтос. У клиничким студијама није било доказа о хепатотоксичности изазваној лековима или повишеном нивоу АЛТ.
Током клиничких испитивања пре САД-а одобрених плацебом у САД-у, укупно 4 од 1526 (0,26%) пацијената лечени Ацтос-ом, а 2 од 793 (0,25%) плацебо лечених пацијената имале су АЛТ вредности ¥ тимес 3 пута више од горње границе нормално. Повишице АЛТ код пацијената лечених Ацтосом биле су реверзибилне и нису биле јасно повезане са терапијом Ацтосом.
У постмаркетиншком искуству са Ацтос-ом примљени су извештаји о хепатитису и повећању ензима јетре до 3 или више пута од горње границе нормале. Врло ретко, ови извештаји укључују грешку јетре са и без смртног исхода, мада узрочност није утврђена.
До очекивања доступности резултата додатних великих, дугорочно контролисаних клиничких испитивања и додатних након података о сигурности након стављања на тржиште, препоручује се да пацијенти лијечени Ацтос-ом периодично прате јетру ензими.
Ниво АЛТ (аланин аминотрансферазе) у серуму треба проценити пре започињања терапије са Ацтос код свих пацијената и периодично након тога, према клиничкој процени здравствене заштите професионални. Тестове јетрених тестова треба добити и пацијентима ако се појаве симптоми који указују на поремећај јетре, нпр. Мучнина, повраћање, бол у трбуху, умор, анорексија или таман урин. Одлука о томе да ли да настави пацијента на терапији Ацтос-ом треба да се заснива на клиничкој процени до лабораторијске процене. Ако се примети жутица, терапију лековима треба прекинути.
Терапија Ацтос-ом не би требало започети ако пацијент покаже клиничке доказе о активној јетри или је ниво АЛТ-а већи од 2,5 пута од горње границе нормале. Пацијенти са благо повишеним јетреним ензимима (ниво АЛТ-а од 1 до 2,5 пута већи од горње границе нормале) на треба одредити почетну вриједност или било које вријеме током терапије Ацтосом како би се утврдио узрок јетрених ензима надморска висина. Започињање или наставак терапије Ацтосом код пацијената са благо повишеним јетреним ензимима треба наставити с опрезом и укључују одговарајуће клиничко праћење које може укључивати учесталије јетрене ензиме праћење. Ако се ниво трансаминаза у серуму повећа (АЛТ> 2,5 пута од горње границе нормале), јетра функционалне тестове треба евалуирати чешће док се нивои не врате у нормалу или претходно обрадити вредности. Ако ниво АЛТ премаши 3 пута горњу границу нормале, тест треба поновити што је пре могуће. Ако ниво АЛТ остане> 3 пута изнад горње границе нормале или ако је пацијент жутица, терапију Ацтосом треба прекинути.
Макуларни едем: Забиљежен је макуларни едем у постмаркетиншком искуству код дијабетичара који су узимали пиоглитазон или неки други тиазолидиндион. Неки пацијенти имају замагљен вид или смањену оштрину вида, али чини се да су неки пацијенти дијагностицирани на рутинском офталмолошком прегледу. Неки пацијенти су имали периферни едем у време када је дијагностикован макуларни едем. Неки пацијенти су имали побољшање свог макуларног едема након престанка узимања тиазолидиндиона. Није познато постоји ли или не узрочно веза између пиоглитазона и макуларног едема. Пацијенти са дијабетесом требали би имати редовне прегледе ока код офталмолога, према стандардима неге Америчке асоцијације за дијабетес. Поред тога, сваки дијабетичар који пријави било који вид визуелних симптома треба одмах да буде упућен офталмологу, без обзира на пацијентове лекове или друге физичке налазе (види НЕЖЕЉЕНЕ РЕАКЦИЈЕ).
Преломи: У рандомизованом испитивању (ПРОацтиве) код пацијената са дијабетесом типа 2 (средње трајање од дијабетес 9,5 година), примећена је повећана учесталост прелома костију код жена које узимају пиоглитазон. Током просечног праћења од 34,5 месеци, учесталост прелома костију код жена била је 5,1% (44/870) за пиоглитазон у односу на 2,5% (23/905) за плацебо. Ова разлика је примећена након прве године лечења и остала је током студије. Већина прелома примећених код пацијенткиња биле су невервертебрални преломи, укључујући доњи и дистални горњи. Није опажено повећање стопе прелома код мушкараца лечених пиоглитазоном 1,7% (30/1735) у односу на плацебо 2,1% (37/1728). Ризик од прелома треба размотрити код неге пацијената, посебно жена које се лече пиоглитазон и пажња треба посветити процени и одржавању здравља костију у складу са тренутним стандардима од бриге.
Макроваскуларни исходи: Није било клиничких студија које би утврдиле коначне доказе о смањењу макроваскуларног ризика уз Ацтос или било који други лек против дијабетеса.
Лабораторијски тестови
ФПГ и ХбА1ц периодично треба вршити мерења ради праћења гликемијске контроле и терапијског одговора на Ацтос.
Препоручује се праћење јетрених ензима пре почетка терапије Ацтос-ом код свих пацијената и периодично након тога, по клиничкој процени здравственог радника (видети МЕРЕ ПРЕДОСТРОЖНОСТИ, Опште, јетрене ефекте и НЕЖЕЉЕНЕ РЕАКЦИЈЕ, Нивои трансаминаза у серуму).
Информације за пацијенте
Важно је упутити пацијенте да се придржавају упутстава о исхрани и да редовно тестирају глукозу у крви и гликозилирани хемоглобин. Током периода стреса, попут врућице, трауме, инфекције или хирургије, захтеви за лековима могу се мењати и пацијенте треба подсетити да одмах потраже лекарску помоћ.
Пацијенти који имају неуобичајено брзо повећање тежине или едема или који имају недостатак даха или друге симптоме срчане инсуфицијенције док Ацтос треба одмах да пријави ове симптоме љекар.
Пацијентима треба рећи да ће се крвни тестови за функцију јетре обављати пре почетка терапије и периодично након тога по клиничкој процени здравственог радника. Пацијентима треба упутити да одмах потраже лекарску помоћ за необјашњиву мучнину, повраћање, бол у трбуху, умор, анорексију или таман урин.
Пацијентима треба рећи да узимају Ацтос једном дневно. Ацтос се може узимати са или без оброка. Ако се доза пропусти једног дана, доза се не сме удвостручити следећег дана.
Када се користи комбинована терапија инсулином или оралним хипогликемијским средствима, ризици хипогликемије, њени симптоми и лечење и стања која предиспонирају његов развој требало би објаснити пацијентима и њиховој породици чланова.
Терапија Ацтос-ом, као и други тиазолидиндиони, може резултирати овулацијом код неких пременопаузалних ановулаторних жена. Као резултат, ове пацијенткиње могу имати повећан ризик за трудноћу док узимају Ацтос. Стога би требало препоручити адекватну контрацепцију код жена у пременопаузи. Овај могући ефекат није испитиван у клиничким студијама, па учесталост ове појаве није позната.
Интеракције са лековима
Студије интеракције лекова и лекова ин виво сугерисале су да пиоглитазон може бити слаб индуктор супстрата ЦИП 450 изоформ 3А4 (видети КЛИНИЧКА ФАРМАКОЛОГИЈА, Метаболизам и Интеракције љекова и дрога).
Ензимски инхибитор ЦИП2Ц8 (као што је гемфиброзил) може значајно повећати АУЦ од пиоглитазон и индуктор ензима ЦИП2Ц8 (као што је рифампин) могу значајно смањити АУЦ од пиоглитазон. Стога, ако се започне или заустави инхибитор или индуктор ЦИП2Ц8 током лечења пиоглитазоном, промене у лечењу дијабетеса могу бити потребне на основу клиничког одговора (видети КЛИНИЧКА ФАРМАКОЛОГИЈА, Интеракције љекова и дрога).
Канцерогенеза, мутагенеза, оштећење плодности
Двогодишње истраживање канцерогености спроведено је код мушких и женских пацова у оралним дозама до 63 мг / кг (отприлике 14 пута више од максималне препоручене оралне дозе од 45 мг на основу мг / м2). Тумови изазвани лековима нису примећени ни у једном органу осим мокраћне бешике. Бенигне и / или малигне неоплазме прелазних ћелија примећене су код мушких пацова од 4 мг / кг / дан и више (приближно једнака максималној препорученој оралној дози за човека на основу мг / м2). Двогодишње истраживање канцерогености извршено је код мушких и женских мишева у оралним дозама до 100 мг / кг / дан (отприлике 11 пута од максималне препоручене оралне дозе за људе на основу мг / м2). Нису примећени тумори изазвани лековима ни на једном органу.
Током проспективне процене уринарне цитологије која је укључивала више од 1800 пацијената који су примали Ацтос у клиничким испитивањима у трајању до једне године, нису утврђени нови случајеви тумора мокраћне бешике. У две трогодишње студије у којима је пиоглитазон упоређен са плацебом или глибуридом, било је 16/3656 (0,44%) извештаји о карциному бешике код пацијената који узимају пиоглитазон у поређењу са 5/3679 (0,14%) код пацијената који не узимају пиоглитазон. Након искључења пацијената код којих је изложеност испитиваном леку била мања од једне године у тренутку дијагнозе карцинома мокраћне бешике, било је шест (0,16%) случајева пиоглитазона и два (0,05%) плацеба.
Пиоглитазон ХЦл није био мутаген у батерији испитивања генетске токсикологије, укључујући Амесов бактеријски тест, напредни ген ћелије сисара. мутацијски тест (ЦХО / ХПРТ и АС52 / КСПРТ), ин витро испитивање цитогенетике помоћу ЦХЛ ћелија, непланирани тест синтезе ДНК и ин виво микронуклеус тест.
Нису примећени штетни ефекти на плодност код мушких и женских пацова у оралним дозама до 40 мг / кг пиоглитазона ХЦл дневно пре парења и током трудноће и трудноће (отприлике 9 пута максималне препоручене оралне дозе за човека на основу мг / м2).
Токицологи за животиње
Примећено је увећање срца код мишева (100 мг / кг), пацова (4 мг / кг и више) и паса (3 мг / кг) који су третирани орално пиоглитазон ХЦл (приближно 11, 1 и 2 пута максимална препоручена орална доза за људе за мишеве, пацове и псе, респективно, на основу мг / м2). У једногодишњем истраживању пацова, рана смрт повезана са лековима услед очите дисфункције срца догодила се у орална доза од 160 мг / кг / дан (приближно 35 пута већа од препоручене оралне дозе за људе на основу мг / м2). Повећање срца примећено је у 13-недељном истраживању на мајмунима оралним дозама од 8,9 мг / кг и више (отприлике 4 пута од максималне препоручене оралне дозе за људе на основу мг / м2), али не у 52-недељном испитивању код оралних доза до 32 мг / кг (отприлике 13 пута више од максималне препоручене оралне дозе за људе на основу мг / м2).
Трудноћа
Трудноћа Категорија Ц. Пиоглитазон није био тератоген код пацова у оралним дозама до 80 мг / кг или код зечева до 160 мг / кг током органогенезе (отприлике 17 и 40 пута већа од препоручене људске оралне дозе на мг / м2, редом). Одгођено рађање и ембриотоксичност (о чему сведоче повећани губици постимплантације, одложен развој и смањена тежина плода) примећени су код пацова код оралних доза од 40 мг / кг / дан и више (отприлике 10 пута највеће препоручене оралне дозе за људе на основу мг / м2). Није опажена функционална или бихевиорална токсичност код потомства пацова. Код кунића примећена је ембриотоксичност оралном дозом од 160 мг / кг (отприлике 40 пута највеће препоручене оралне дозе за људе на основу мг / м2). Одгођен постнатални развој, приписан смањеној телесној тежини, примећен је код потомства пацова оралним дозама од 10 мг / кг и више током периода касне гестације и дојења (отприлике 2 пута максималне препоручене оралне дозе за људе на основу мг / м2).
Не постоје адекватне и добро контролисане студије на трудницама. Ацтос треба користити током трудноће само ако потенцијална корист оправдава потенцијални ризик за плод.
Будући да тренутне информације снажно указују на то да су ненормалне вредности глукозе у крви током трудноће повезане и са већом учесталошћу урођених аномалија Како повећани неонатални морбидитет и морталитет, већина стручњака препоручује употребу инсулина током трудноће како би се ниво глукозе у крви одржао што ближе нормалном могуће.
Неговане мајке
Пиоглитазон се излучује у млеку дојећих пацова. Није познато да ли се Ацтос излучује у мајчином млеку. Будући да се многи лекови излучују у мајчином млеку, Ацтос не треба давати жени која доји.
Педијатријска употреба
Сигурност и ефикасност Ацтоса код педијатријских пацијената нису утврђене.
Употреба старијих особа
Отприлике 500 пацијената у плацебо контролисаним клиничким испитивањима Ацтоса било је 65 и више година. Нису примећене значајне разлике у ефикасности и безбедности између ових и млађих пацијената.
врх
Нежељене реакције
Преко 8500 пацијената са дијабетесом типа 2 лечено је Ацтос-ом у рандомизованим, двоструко слепим, контролисаним клиничким испитивањима. Ово укључује 2605 високо ризичних пацијената са дијабетесом типа 2 лечених Ацтос-ом из клиничког испитивања ПРОацтиве. Преко 6000 пацијената лечено је шест месеци или дуже, а преко 4500 пацијената током једне или дуже године. Преко 3000 пацијената је примило Ацтос најмање 2 године.
Укупна учесталост и врсте нежељених догађаја пријављених у плацебо контролираним клиничким испитивањима Ацтос монотерапије у дозама од 7,5 мг, 15 мг, 30 мг или 45 мг једном дневно приказани су у Табели 7.
Табела 7 Плацебо-контролирана клиничка испитивања монотерапије Ацтос-ом: нежељени догађаји пријављени у учесталости ‰ ¥ 5% пацијената лијечених Ацтос-ом
| (% пацијената) | ||
| Плацебо Н = 259 |
Ацтос Н = 606 |
|
| Инфекције горњих дисајних путева | 8.5 | 13.2 |
| Главобоља | 6.9 | 9.1 |
| Синуситис | 4.6 | 6.3 |
| Миалгиа | 2.7 | 5.4 |
| Поремећај зуба | 2.3 | 5.3 |
| Дијабетес мелитус погоршан | 8.1 | 5.1 |
| Фарингитис | 0.8 | 5.1 |
За већину клиничких нежељених догађаја инциденција је била слична за групе лечене монотерапијом Ацтос и оне које су лечене у комбинацији са сулфонилуреама, метформином и инсулином. Повећана је појава едема код пацијената лечених Ацтос-ом и инсулином у поређењу са самим инсулином.
У 16-недељном, плацебо контролисаном испитивању Ацтос плус инсулину (н = 379), 10 пацијената лечених Ацтос плус инзулин развила диспнеју и такође, у неком тренутку током своје терапије, развила или промену тежине или едем Седам од тих 10 пацијената примило је диуретике за лечење ових симптома. Ово није пријављено у групи са инсулином плус плацебом.
Учесталост повлачења из плацебо-контролисаних клиничких испитивања због нежељеног догађаја који није хипергликемија била је слична код пацијената лечених плацебом (2,8%) или Ацтос (3,3%).
У студијама контролисане комбиноване терапије било са сулфонилурејом или инсулином, пријављена је блага до умерена хипогликемија, за коју се чини да је повезана са дозом (видети МЕРЕ ПРЕДОСТРОЖНОСТИ, Опште, Хипогликемија и Дозирање и администрација, Комбинована терапија).
У двоструко слепим студијама САД-а, анемија је забележена код ¤% 2% пацијената лечених Ацтос-ом плус сулфонилурејом, метформином или инсулином (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Опште, хематолошке).
У испитивањима монотерапије забележен је едем за 4,8% (са дозама од 7,5 мг до 45 мг) пацијената лечених Ацтосом у поређењу са 1,2% пацијената који су лечили плацебо. У студијама комбиноване терапије забележен је едем за 7,2% пацијената лечених Ацтос-ом и сулфонилурееима у поређењу са 2,1% пацијената који су једини на сулфонилуреји. У студијама комбиноване терапије метформином, забележен је едем код 6,0% пацијената на комбинованој терапији у поређењу са 2,5% пацијената који су узимали само метформин. У студијама комбиноване терапије инсулином пријављен је едем код 15,3% пацијената на комбинованој терапији у поређењу са 7,0% пацијената који су једини на инсулину. Већина ових догађаја сматрана је благим или умереним интензитетом (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Опште, Едема).
У једном 16-недељном клиничком испитивању инсулина плус Ацтос комбиноване терапије, више пацијената је развило конгестивно затајење срца на комбинованој терапији (1,1%) у поређењу са ниједним само на инсулину (види УПОЗОРЕЊА, Затајивање срца и други кардиолошки ефекти).
Проспективно клиничко испитивање пиоглитазона у макроваскуларним догађајима (проактивно)
У ПРОацтиве-у је било 5238 пацијената са дијабетесом типа 2 и макроровакуларном болешћу који су имали историју раније третирани Ацтосом (н = 2605), с титром силе до 45 мг дневно или плацебом (н = 2633) поред стандардног од бриге. Скоро сви испитаници (95%) примали су кардиоваскуларне лекове (бета блокатори, АЦЕ инхибитори, АРБ, блокатори калцијумских канала, нитрати, диуретици, аспирин, статини, фибрати). Пацијенти су имали просечну старост од 61,8 година, средње трајање дијабетеса 9,5 година, а средња вредност ХбА1ц 8,1%. Просечно трајање праћења било је 34,5 месеци. Примарни циљ овог испитивања био је испитивање утицаја Ацтоса на смртност и макроваскуларни морбидитет код пацијената са шећерном болешћу типа 2 који су били под високим ризиком макроваскуларни догађаји. Примарна варијабла ефикасности била је време до прве појаве било ког догађаја у кардиоваскуларној композитној крајњој тачки (видети табелу 8 доле). Иако није постојала статистички значајна разлика између Ацтос-а и плацеба за трогодишњу инциденцију Први догађај у овом саставу није имао пораст смртности нити укупан макроваскуларни догађај са Ацтос.
Табела 8 Број првих и укупних догађаја за сваку компоненту унутар кардиоваскуларне композитне крајње тачке
| Плацебо Н = 2633 |
Ацтос Н = 2605 |
|||
| Кардиоваскуларни догађаји | Први догађаји (Н) |
Укупно догађаја (Н) |
Први догађаји (Н) |
Укупно догађаја (Н) |
| Било који догађај | 572 | 900 | 514 | 803 |
| Смртност без узрока | 122 | 186 | 110 | 177 |
| Нефатални МИ | 118 | 157 | 105 | 131 |
| Удар | 96 | 119 | 76 | 92 |
| АЦС | 63 | 78 | 42 | 65 |
| Срчана интервенција | 101 | 240 | 101 | 195 |
| Велика ампутација ногу | 15 | 28 | 9 | 28 |
| Реваскуларизација ногу | 57 | 92 | 71 | 115 |
Примљени су и извештаји о новом појављивању или погоршавању дијабетичких едема макуле са смањеном оштрином вида (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Опште, Макуларни едем).
Лабораторијске неправилности
Хематолошки: Ацтос може узроковати смањење хемоглобина и хематокрита. Пад хемоглобина и хематокрита са Ацтосом изгледа да је повезан са дозом. У свим клиничким студијама, просечне вредности хемоглобина опале су за 2% до 4% код пацијената лечених Ацтос-ом. Ове промене су се углавном десиле у првих 4 до 12 недеља терапије и после тога су остале релативно стабилне. Ове промене могу бити повезане са повећаним волуменом плазме повезане са терапијом Ацтосом и ретко су повезане са било којим значајним хематолошким клиничким ефектима.
Нивои трансаминаза у серуму: Током свих клиничких студија у САД-у, 14 од 4780 (0,30%) пацијената лечених Ацтос-ом имало је АЛТ вредности ¥ тимес 3 пута више од горње границе нормале током лечења. Сви пацијенти са вредностима праћења имали су реверзибилно повишено АЛТ. У популацији пацијената лечених Ацтос-ом, средње вредности билирубина, АСТ-а, АЛТ-а, алкалне фосфатазе и ГГТ-а смањене су у последњој посети у поређењу са почетном вриједности. Мање од 0,9% пацијената лечених Ацтос-ом повучено је из клиничких испитивања у САД-у због ненормалних тестова функције јетре.
У клиничким испитивањима која су претходила одобравању, није било случајева идиосинкратских реакција на лекове који би довели до затајења јетре (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Општи, јетрени ефекти).
Нивои ЦПК: Током обавезног лабораторијског испитивања у клиничким испитивањима примећена су спорадична, пролазна повишења нивоа креатин фосфокиназе (ЦПК). Забиљежено је изолирано повишење веће од 10 пута више од горње границе нормале код 9 болесника (вриједности од 2150 до 11400 ИУ / Л). Шест ових пацијената је наставило да прима Ацтос, а два пацијента су завршила студију лекови у време повишене вредности и један пацијент је прекинуо испитивање лекова због надморска висина. Ова пораста су ријешена без видљивих клиничких посљедица. Однос ових догађаја са Ацтос терапијом није познат.
врх
Предозирање
Током контролисаних клиничких испитивања пријављен је један случај предозирања Ацтос-ом. Мушки пацијент је узимао 120 мг дневно током четири дана, а затим 180 мг дневно током седам дана. Пацијент је негирао било какве клиничке симптоме током овог периода.
У случају предозирања, потребно је започети одговарајући супортивни третман у складу са клиничким знацима и симптомима пацијента.
врх
Дозирање и администрација
Ацтос треба узимати једном дневно, без обзира на оброке.
Управљање антидијабетичком терапијом треба индивидуализовати. У идеалном случају, одговор на терапију треба проценити коришћењем ХбА1ц што је бољи показатељ дугорочне контроле гликемије него сам ФПГ. ХбА1ц одражава гликемију у последња два до три месеца. У клиничкој употреби, препоручује се да се пацијенти лече Ацтос-ом током периода који је адекватан за процену промене ХбА1ц (три месеца), осим ако се контрола гликемије не погорша. Након започињања Ацтоса или повећања дозе, пацијенте треба пажљиво надгледати због нежељених догађаја повезаних са задржавањем течности (види БОКСЕД УПОЗОРЕЊЕ и УПОЗОРЕЊА).
Монотерапија
Монотерапија Ацтос-ом код пацијената који нису адекватно контролисани дијетом и вежбањем може се започети са 15 мг или 30 мг једном дневно. За пацијенте који неадекватно реагују на почетну дозу Ацтоса, доза се може повећавати у корацима до 45 мг једном дневно. Код пацијената који не реагују адекватно на монотерапију, треба размотрити комбиновану терапију.
Комбинована терапија
Сулфонилурее: Ацтос у комбинацији са сулфонилурејом може се започети са 15 мг или 30 мг једном дневно. Тренутна доза сулфонилуреје може се наставити након започињања Ацтос терапије. Ако пацијенти извештавају о хипогликемији, дозу сулфонилуреје треба смањити.
Метформин: Ацтос у комбинацији са метформином може се започети у дози од 15 мг или 30 мг једном дневно. Тренутна доза метформина може се наставити након започињања Ацтос терапије. Мало је вероватно да ће доза метформина захтевати прилагођавање због хипогликемије током комбиноване терапије са Ацтос-ом.
Инсулин: Ацтос у комбинацији са инсулином може се започети са 15 мг или 30 мг једном дневно. Тренутна доза инсулина може се наставити након започињања Ацтос терапије. Код пацијената који примају Ацтос и инзулин, доза инсулина може се смањити за 10% до 25% ако пацијент пријави хипогликемију или ако се концентрација глукозе у плазми смањи на мање од 100 мг / дЛ. Даљња прилагођавања треба индивидуализовати на основу реакције на снижавање глукозе.
Максимална препоручена доза
Доза Ацтоса не сме бити већа од 45 мг једном дневно у монотерапији или у комбинацији са сулфонилурејом, метформином или инсулином.
Не препоручује се прилагођавање дозе код пацијената са бубрежном инсуфицијенцијом (види КЛИНИЧКА ФАРМАКОЛОГИЈА, Фармакокинетика и метаболизам лекова).
Терапија Ацтос-ом не би требало започети ако пацијент покаже клиничке доказе о активној јетри или повећане нивое трансаминаза у серуму (АЛТ већи од 2,5 пута од горње границе нормале) на почетку терапије (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Опште, јетрене ефекте и КЛИНИЧКА ФАРМАКОЛОГИЈА, Специјалне популације, инсуфицијенција јетре). Праћење јетрених ензима препоручује се свим пацијентима пре почетка терапије Ацтосом и периодично након тога (види МЕРЕ ПРЕДОСТРОЖНОСТИ, Општи, јетрени ефекти).
Нема података о употреби Ацтоса код пацијената млађих од 18 година; стога се не препоручује употреба Ацтоса код педијатријских пацијената.
Нема података о употреби Ацтоса у комбинацији са другим тиазолидиндионом.
врх
Како се испоручује
Ацтос је доступан у таблетама од 15 мг, 30 мг и 45 мг на следећи начин:
Таблета од 15 мг: бела до сиво-бела, округла, конвексна, неисправана таблета са "Ацтос" на једној страни и "15" на другој, доступно у:
НДЦ 64764-151-04 Бочице од 30
НДЦ 64764-151-05 Боце од 90
НДЦ 64764-151-06 Бочице од 500
30 мг таблета: бела до сиво-бела, округла, равна, неисправана таблета са "Ацтос" на једној страни и "30" на другој, доступно у:
НДЦ 64764-301-14 Бочице од 30
НДЦ 64764-301-15 Боце од 90
НДЦ 64764-301-16 Бочице од 500
Таблета од 45 мг: бела до сиво бела, округла, равна, неисправана таблета са "Ацтос" на једној страни и "45" на другој, доступно у:
НДЦ 64764-451-24 Бочице од 30
НДЦ 64764-451-25 Бочице од 90
НДЦ 64764-451-26 Бочице од 500
СКЛАДИШТЕ
Чувати на 25 ° Ц; излети дозвољени на 15-30 ° Ц (види температуру у соби под контролом УСП-а). Чувати спремник чврсто затвореним и заштитити од влаге и влаге.
врх
Референце
- Денг, Љ и др. Утицај гемфиброзила на фармакокинетику пиоглитазона. Еур Ј Цлин Пхармацол 2005; 61: 831-836, Табела 1.
2. Јааккола, Т и др. Утицај рифампицина на фармакокинетику пиоглитазона. Цлин Пхармацол Брит Јоур 2006; 61:1 70-78.
Само Рк
Произведен од:
Такеда Пхармацеутицал Цомпани Лимитед
Осака, Јапан
Маркетирао:
Такеда Пхармацеутицалс Америца, Инц.
Један парк Такеда
Деерфиелд, ИЛ 60015
Ацтос® је регистровани заштитни знак компаније Такеда Пхармацеутицал Цомпани Лимитед и користи га под лиценцом компаније Такеда Пхармацеутицалс Америца, Инц.
Сва друга имена заштитних знакова власништво су њихових власника.
Последње ажурирано: 08.09
Ацтос, пиоглитазоне хцл, информације о пацијенту (на обичном енглеском)
Детаљне информације о знаковима, симптомима, узроцима, лечењу дијабетеса
Информације у овој монографији нису намијењене покривању свих могућих употреба, упута, мјера опреза, интеракције лијекова или штетних учинака. Ове информације су уопштене и нису замишљене као посебни медицински савети. Ако имате питања о лековима које узимате или желите више информација, обратите се свом лекару, фармацеуту или медицинској сестри.
назад на: Прегледајте све лекове за дијабетес


